
毛细胞白血病(HCL)是一种慢性B淋巴细胞增殖性疾病,临床患者多表现为全血细胞减少和脾大,病程进展缓慢。HCL的诊断主要依据典型骨髓细胞形态学、免疫表型和特定的分子生物学异常。HCL的经典一线治疗方案以嘌呤类似物(PNA)克拉屈滨和喷司他汀±利妥昔单抗为主,但约50%患者接受一线治疗后,仍发生难治或疾病复发。随着近年对HCL发病机制认识的加深,以BRAF抑制剂、抗CD22重组免疫毒素,以及Bruton酪氨酸激酶(BTK)抑制剂为代表的新型药物,在复发/难治性HCL患者治疗中发挥重要作用。笔者拟就HCL的疾病特点和诊疗研究进展进行综述,旨在为现有HCL治疗程序的更新提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
毛细胞白血病(hairy cell leukemia,HCL)是一种罕见的慢性B淋巴细胞增殖性疾病,约占全部白血病的2%[1]。该病好发于老年人,中位发病年龄为63岁,男、女比例为(4~5)∶1[2],患者的主要临床表现为脾大及全血细胞减少。本病最初于1958年被Bouroncle等[3]发现,并将其命名"白血病网状内皮组织增生症"。此后,由于HCL细胞在电子显微镜下呈现特征性的毛状突起,故被正式命名为HCL。该病诊断主要根据HCL细胞特征性的形态学证据,特殊的流式细胞术(flow cytometry,FCM)免疫表型,以及分子生物学异常(BRAF V600E体细胞突变)检测结果。目前,对有症状的HCL患者采取的一线治疗是以嘌呤类似物(purine nucleoside analogues,PNA)为基础的化疗,PNA联合利妥昔单抗的化学免疫疗法的应用亦逐渐增多。虽然HCL患者对一线化疗的治疗反应良好,但仍有近50%患者发生复发或难治,复发/难治者的治疗则依赖于新型药物,包括BRAF抑制剂、抗CD22重组免疫毒素,以及Bruton酪氨酸激酶(Bruton tyrosine kinase,BTK)抑制剂伊布替尼。笔者拟就HCL的疾病特点和近年的诊疗研究进展进行综述如下,旨在总结目前对HCL的生物学认识,以及为现有诊疗程序的更新提供参考。
目前,HCL的病因及发病机制尚未完全明确。Tiacci等[4]在几乎所有纳入研究的HCL患者中,均发现BRAF基因编码丝氨酸/苏氨酸蛋白激酶V600E位点的功能获得性突变。BRAF基因是一种原癌基因,其最常见的突变位点即V600E,该位点突变激活RAS/RAF/MEK/ERK信号通路,而该通路的异常激活,则导致细胞过度生长及增殖[5]。在HCL细胞中,BRAF突变激活是一个核心的基因驱动因素,因为其在HCL细胞克隆的全过程中均可被检测到,并且在疾病复发时高度稳定,提示BRAF突变与HCL的发病密切相关。与经典型HCL(classic HCL,HCL-C)不同,HCL的2种高风险变异型:HCL变异型(HCL variant,HCL-V)和免疫球蛋白重链可变区(immunoglobulin heavy chain variable region,IGHV)4-34基因重排阳性的HCL类型,即VH4-34+ HCL,通常不伴BRAF V600E突变,并且对单药PNA治疗反应差,患者预后亦较差[6,7]。Waterfall等[8]发现,约50%的HCL-V和VH4-34+ HCL患者携带MAP2K1突变,而MAP2K1突变位于BRAF突变位点下游,同样导致MAPK信号通路激活。此外,对HCL患者诊断和复发时BRAF基因序列样本测序结果显示,在15%(3/20)复发患者中观察到Krüppel样因子(Krüppel-like factor,KLF)2失活突变[9]。KLF2是一个控制多种B细胞亚群分化的转录因子,在B淋巴细胞归巢和抑制核因子-κB信号通路中发挥关键作用[9]。Dietrich等[10]研究发现,16%(13/81)HCL患者存在细胞周期抑制因子CDNK1B体细胞突变,并且与BRAF V600E同时存在,这表明CDNK1B突变在HCL发病中亦发挥作用。此外,表观遗传学基因突变也参与HCL发病,15%(8/53)HCL-C患者存在组蛋白甲基化酶基因KTM2C的反复失活突变,而组蛋白去甲基化基因KDM6A和组蛋白乙酰化基因CREBBP突变则较少见[11]。其他突变如染色质重构复合物基因ARID1B及NOTCH信号通路相关基因NOTCH1突变,也在HCL患者基因序列样本中被检测到[9]。由此可见,BRAF V600E突变是HCL发病的关键驱动基因突变,并且通过对复发HCL患者的基因测序研究还发现其他基因突变,如KLF2、CDNK1B突变及表观遗传学改变亦参与HCL复发,这有望为复发患者探索更多治疗选择。
HCL诊断依赖于HCL细胞特征性的形态学证据,基于CD11c、CD103、CD123和CD25表达的HCL免疫学评分达到3~4分,骨髓活组织病理学检查明确肿瘤浸润程度,以及BRAF V600E体细胞突变的检测结果。首先,HCL最主要的诊断依据是外周血涂片和(或)骨髓涂片检查中发现HCL细胞,即毛细胞。85%患者外周血涂片可见毛细胞,其数量约占白细胞总数的20%。毛细胞具有以下特点:细胞体积不一,较正常淋巴细胞大1~2倍,呈圆形或多角形,肾形核,染色质疏松,核仁不明显,细胞质呈淡蓝色可有嗜天青颗粒,细胞质边界不齐呈锯齿状,在电子显微镜下可见细胞外不规则纤绒毛突起[12]。毛细胞酸性磷酸酶染色呈阳性,且不被酒石酸所抑制,即耐酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)呈阳性。全血细胞分类计数和外周血涂片检查是HCL细胞特殊形态学鉴定的第一步,同时还应进行骨髓活组织检查,以评估白血病细胞的骨髓浸润程度。几乎所有HCL患者骨髓受累,常伴严重的骨髓纤维化而导致骨髓干抽,骨髓活组织检查通常表现为毛细胞灶性浸润,同时伴间质广泛淋巴细胞浸润[13],罕见窦内浸润[14]。
其次,HCL细胞具有相对成熟的B细胞免疫表型,单克隆强表达表面免疫球蛋白(surface immunoglobulin,sIg),强表达CD19、CD20、CD22、CD11c和CD200,通常表达CD103、CD123、CD25、CD79a、FMC(fast migrating cerebrosides)-7及膜联蛋白(annexin,ANX)A1,其中ANXA1是B细胞表面最具特异性的分子标志物,而CD5、CD23、CD10、CD27和CD43表达通常呈阴性。HCL的免疫学评分是基于CD11c、CD103、CD123和CD25表达,若以上免疫学标志物呈阳性,则计为1分,98% HCL患者的免疫学评分可达到3或4分,而其他非典型HCL疾病,如HCL-V或伴绒毛淋巴细胞的脾淋巴瘤(splenic diffuse red pulp lymphoma,SDRPL)得分通常仅为0或1分[15]。因此,通过FCM鉴定HCL细胞特殊的免疫表型,可进行更精确地诊断。此外,通过CD20、ANAX1免疫组织化学染色[16],可明确识别骨髓中典型HCL细胞,从而评估骨髓中HCL细胞的浸润程度,有助于明确诊断。
最后,HCL具有相对特异的分子生物学异常,几乎所有HCL-C患者都存在BRAF V600E突变,通过BRAF VE1抗体免疫组织化学染色,可在骨髓活组织检查中检测出突变型蛋白,从而提高HCL诊断的准确性[17]。BRAF V600E突变检测不但具有重要的诊断价值,而且对于复发/难治性HCL患者的靶向治疗具有提示作用,因为BRAF抑制剂有可能成为潜在治疗药物[18,19,20]。因此,在诊断HCL时,建议使用二代测序或特异性等位基因PCR等高灵敏度的检测技术,评估患者是否存在BRAF V600E突变[21]。此外,80%~90%的HCL患者存在IGHV家族的突变。Arons等[22]研究发现,83%(85/102)的HCL-C患者及46%(13/28)的HCL-V患者存在IGHV体细胞高频突变(somatic hypermutation,SHM),而IGHV未突变型HCL侵袭性更高,疾病进展快,对PNA单药治疗反应差,因此IGHV未突变被视为HCL预后不良的分子标志物之一[23]。此外,该研究对126例HCL患者的130个IGHV-D-J基因序列分析发现,HCL-C患者最常发生基因重排的片段为VH3-23(17%,17/102),其次为VH3-30(8%,8/102)和VH4-34(7%,7/102),而在HCL-V患者最常发生VH4-34(36%,10/28)。VH4-34+ HCL是一种预后较差的HCL特殊类型,VH4-34+ HCL患者(n=13)对克拉屈滨单药治疗的主要缓解率,较VH4-34- HCL患者(n=48)显著降低[15%(2/13)比83%(40/48),P<0.001],且无进展生存(progression free survival,PFS)期显著缩短(5.1个月比22.8个月,P=0.007)[6]。
对HCL进行诊断时,需与HCL-V,脾边缘区淋巴瘤(splenic marginal zone lymphoma,SMZL)和脾弥漫性红髓小B细胞淋巴瘤(splenic diffuse red pulp small B-cell lymphoma,SDRPSBL)等类似疾病相鉴别(表1)。HCL-V是HCL的一种罕见变异型,发生率约为10%,其临床病程较HCL-C更具侵袭性。HCL-V患者不仅形态学与HCL不同,其临床表现也不尽相同,HCL患者通常因全血细胞减少而被发现,单核细胞减少是HCL较为敏感和特异性的表现[13],而HCL-V患者临床上通常表现为白细胞增多。区别二者的最佳方法为免疫表型,HCL-V免疫表型为CD25、CD123、ANXA1均呈阴性,并且通常不伴BRAF V600E突变,MAP2K1突变HCL-V患者的诊断依据之一,在50% HCL-V患者中可检出MAP2K1突变[24]。另一种需与HCL鉴别的疾病是SMZL,其主要累及脾、脾门淋巴结、骨髓和血液。HCL患者脾受累通常局限于红髓,而SMZL多同时累及红髓和白髓。SMZL患者外周血中SMZL细胞同样表现为细胞质绒毛状突起,但多呈典型的极性分布,且其免疫表型与HCL明显不同,CD25、CD103和ANXA1通常呈阴性。SDRPSBL是一种罕见的小B细胞淋巴瘤,特点是脾红髓中绒毛状淋巴细胞的弥漫性浸润,SDRPSBL细胞的细胞质中存在类似于SMZL细胞呈极性分布的绒毛状突起,免疫表型同样表现为CD25、CD11c、CD123和ANXA1均呈阴性。SDRPSBL和SMZL患者的基因突变与HCL不同,前两者均缺乏BRAF V600E突变。既往研究发现,在SMZL患者中可检测到KLF和NOTCH2反复突变,CCND3突变也被发现发生于少数SMZL和SDRPL患者中[24,25,26]。24%(10/42)SDRPL患者中发现编码B细胞淋巴瘤/白血病因子(B cell lymphoma/leukemia, Bcl)-6辅助抑制因子的BCOR基因反复突变或丢失,而仅在2% SMZL患者中检出该突变[26]。由于SDRPSBL和SMZL的临床表现与HCL相似,且缺乏特异性的分子标志物,鉴别诊断均需依赖于脾组织病理学检查。
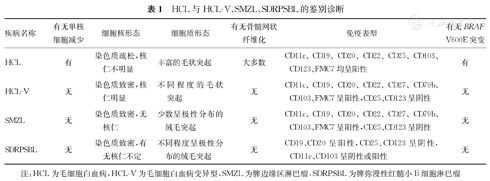
HCL与HCL-V、SMZL、SDRPSBL的鉴别诊断
HCL与HCL-V、SMZL、SDRPSBL的鉴别诊断
| 疾病名称 | 有无单核细胞减少 | 细胞核形态 | 细胞质形态 | 有无骨髓网状纤维化 | 免疫表型 | 有无BRAF V600E突变 |
|---|---|---|---|---|---|---|
| HCL | 有 | 染色质疏松,核仁不明显 | 丰富的毛状突起 | 大多数 | CD11c、CD19、CD20、CD22、CD25、CD103、CD123、FMC7均呈阳性 | 有 |
| HCL-V | 无 | 染色质致密,核仁明显 | 不同程度的毛状突起 | 无 | CD11c、CD19、CD20、CD22、CD27、CD79b、CD103、FMC7呈阳性,CD25、CD123呈阴性 | 无 |
| SMZL | 无 | 染色质致密,无核仁 | 少数呈极性分布的绒毛突起 | 无 | CD11c、CD19、CD20、CD22、CD27、CD79b、CD103、FMC7呈阳性,CD25、CD123呈阴性 | 无 |
| SDRPSBL | 无 | 染色质致密,有无核仁不定 | 不同程度呈极性分布的绒毛突起 | 无 | CD19、CD20呈阳性,CD25、CD123呈阴性,CD11c、CD103呈阴性或阳性 | 无 |
注:HCL为毛细胞白血病,HCL-V为毛细胞白血病变异型,SMZL为脾边缘区淋巴瘤,SDRPSBL为脾弥漫性红髓小B细胞淋巴瘤
大多数HCL患者需接受治疗,但约10%的无症状HCL患者不需要确证后立即治疗,只需观察及长期随访[27]。HCL治疗指征如下:有全身症状,如不明原因的体重减少(6个月内减轻>10%)或明显疲劳;反复感染;血红蛋白值<110 g/L;血小板计数<105/μL;绝对中性粒细胞计数<103/μL;症状性脾大;进行性淋巴细胞增多或淋巴结大。
目前,PNA仍然是HCL患者的主要治疗手段,克拉屈滨或喷司他丁单药治疗是标准一线治疗方案(图1)。法国一项大型回顾性研究共纳入487例HCL患者,其中78%(380/487)的患者采用PNA(克拉屈滨或喷司他丁)作为一线治疗药物,一线PNA治疗后,患者的完全缓解(complete remission,CR)率达到83%(315/380),并且接受克拉屈滨(n=281)和喷司他丁(n=99)治疗者的CR率比较,差异无统计学意义[83%(234/281)比82%(81/99),P=0.968],接受克拉屈滨者的5和10年总体生存(overall survival,OS)率分别为97%和93%[28]。一项英国的回顾性研究结果显示,242例HCL患者接受以喷司他丁(n=188)和克拉屈滨(n=54)的一线治疗后,其CR率分别为82%(154/188)和76%(41/54),二者比较,差异无统计学意义(P>0.05);部分缓解(partial remission,PR)率分别为14%(26/188)和24%(13/54)[29]。此外,前瞻性Ⅱ期临床研究结果表明,采用克拉屈滨联合利妥昔单抗治疗HCL患者,可使患者CR率提高,并清除微小残留病(minimal residual disease,MRD),实现持久、有效的深度缓解[30]。该研究共纳入68例HCL患者,并将其分为克拉屈滨和利妥昔单抗同时给药组[n=34,静脉滴注克拉屈滨0.15 mg/(kg·d)×5 d,利妥昔单抗375 mg/(m2·次),1次/周×8周],克拉屈滨和利妥昔单抗先后给药组[n=34,克拉屈滨0.15 mg/(kg·d)单药治疗6个月后,若患者外周血中检出MRD,则采用利妥昔单抗375 mg/(m2·次),1次/周×8周],克拉屈滨和利妥昔单抗同时给药组患者的MRD-CR率[97%(33/34)比24%(8/34),P<0.000 1]及外周血MRD阴性率[100%(34/34)比50%(17/34),P<0.000 1],均高于先后给药组,并且差异均有统计学意义[30]。该结果提示,与接受克拉屈滨治疗6个月后延迟使用利妥昔单抗的HCL患者相比,接受2种药物同时给药者可获得持久的MRD-CR。此外,感染是HCL患者死亡的主要原因[31]。对于伴感染的HCL患者,在使用PNA之前需控制感染;若暂时无法控制感染,则可以考虑使用α干扰素或BRAF抑制剂维罗非尼进行过渡治疗。
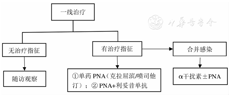

注:HCL为毛细胞白血病,PNA为嘌呤类似物
根据对HCL患者长期随访数据可知,约50% HCL患者在接受一线治疗后5年内复发[2]。既往接受PNA治疗后复发的HCL患者预后欠佳,且OS率显著降低[32]。二线治疗方案的选择取决于首次治疗达到CR后的持续时间,对于CR持续时间>2年的复发患者,若一线治疗采用的方案为克拉屈滨单药治疗,则二线治疗可选择克拉屈滨联合利妥昔单抗治疗(图2)。一项Ⅱ期临床试验结果显示,14例复发HCL患者经克拉屈滨序贯利妥昔单抗治疗后,全部患者获得CR,5年无失败生存(failure-free survival,FFS)和OS率均为100%,接受两药联合治疗者的中位持续缓解时间较单药克拉屈滨治疗者显著延长(未达到比72个月,P=0.004);若患者一线已使用两药联合治疗,复发时则可选择其他PNA或CD20单克隆抗体继续联合治疗,或是采用苯达莫司汀联合CD20单克隆抗体治疗[33]。苯达莫司汀兼具烷化剂和PNA的双重作用机制,可以和利妥昔单抗联用发挥抗HCL作用。一项纳入12例复发/难治性HCL患者的临床试验,对患者分别采用苯达莫司汀70 mg/m2(n=6)和90 mg/m2(n=6),同时联合利妥昔单抗375 mg/m2治疗后,其总缓解率(overall response rate,ORR)为100%(12/12),中位随访时间为31个月时,二者的CR率分别为50%(3/6)和67%(4/6),CR者中MRD阴性率分别为67%(2/3)和100%(4/4),并且MRD阴性者可获得持续CR[34]。HCL患者的二线治疗方案,见图2。
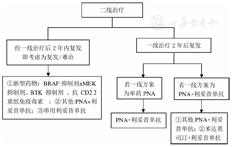

注:HCL为毛细胞白血病,MEK为有丝分裂原活化蛋白激酶激酶,BTK为Bruton酪氨酸激酶,PNA为嘌呤类似物
若HCL患者接受一线治疗后2年之内出现早期复发,则考虑为复发/难治性HCL,其应首选新型药物治疗。目前,复发/难治性HCL患者可选择的新型药物包括BRAF抑制剂、BTK抑制剂和抗CD22重组免疫毒素等。
维罗非尼(vemurafenib)是一种小分子BRAF抑制剂,BRAF V600E下游靶点的药效学分析表明,维罗非尼(480 mg/d)可完全消除肿瘤细胞中BRAF信号通路下游分子磷酸化细胞外信号调节激酶(extracellular signal regulated kinase,ERK)的表达[35]。一项维罗非尼单药治疗HCL患者的Ⅱ期临床试验显示,维罗非尼可显著改善患者的血常规,患者的血小板、中性粒细胞和血红蛋白的中位恢复时间分别为28、43、55 d,最终有40%(6/15)的患者达到CR[35]。维罗非尼治疗HCL患者的不良反应多表现为关节痛、轻度转氨酶升高、皮肤光不良反应,少数出现皮肤肿瘤,服用药物期间需严密监测血常规、肝肾功能等实验室指标及局部皮肤表现。此外,联用BRAF抑制剂和有丝分裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase, MEK)抑制剂在治疗复发/难治性伴BRAF V600E突变的HCL患者中可获得显著临床效果。一项Ⅱ期临床试验对BRAF抑制剂达拉非尼联合MEK抑制剂曲美替尼治疗复发/难治性HCL患者的疗效进行评估,该试验共纳入43例经PNA治疗无效或既往2次治疗后复发的BRAF V600E突变阳性患者,治疗后其ORR达78%(32/41),CR率为49%(20/41),15%(6/41)的CR患者达到MRD阴性,12个月的PFS和OS率均为97.6%[36]。这提示,达拉非尼联合曲美替尼治疗复发/难治且伴BRAF V600E突变的HCL患者,具有较高的持久反应率。
伊布替尼是一种特异性BTK抑制剂。BTK是构成B细胞受体信号通路的一种酪氨酸激酶,该信号通路在B淋巴细胞肿瘤发生及发展过程中发挥重要作用,因此BTK抑制剂可抑制B细胞肿瘤的存活和增殖。一项伊布替尼用于治疗复发HCL及HCL-V患者的Ⅱ期临床研究共纳入37例患者,包括28例HCL-C和9例HCL-V患者,结果显示中位随访时间为3.5年(0~5.9年)时,患者最佳ORR为54%(20/37),3年PFS和OS率分别为73%和85%,常见不良事件(adverse events,AE)包括腹泻(59%)、疲劳(54%)、肌痛(54%)和恶心(51%),以及血液学不良事件[贫血(43%),血小板减少(41%)和中性粒细胞减少(35%)][37]。这说明,HCL患者可从伊布替尼治疗中获得临床获益,同时治疗相关AE可控。
moxetumomab pasudotox是一种将细菌毒素与针对HCL细胞表面特定靶点CD22的单克隆抗体可变区域融合的组合物,成为治疗HCL的一种新的治疗选择。一项多中心单臂研究入组80例复发/难治性HCL患者,患者接受moxetumomab pasudotox治疗后,CR率为41%(33/80),ORR为75%(60/80),27例(82%)CR患者达到MRD阴性。常见的治疗相关AE包括外周水肿(39%)、恶心(35%)、疲劳(34%)和头痛(33%),严重AE包括与治疗相关的溶血性尿毒症综合征(7.5%)和毛细血管泄漏综合征(5%),并且需通过停药和对症支持治疗管理[38]。
随着PNA的应用,初诊HCL患者的疾病控制和OS得到显著改善,目前临床应着眼于复发/难治性HCL患者的治疗,基于BRAF/MEK/ERK和B细胞受体信号通路在HCL中的重要作用,维罗非尼、达拉菲尼/曲美替尼和伊布替尼等小分子信号通路抑制剂,已经在复发/难治性HCL患者中表现出显著疗效和良好的安全性。抗体类药物,如利妥昔单抗和抗CD22重组免疫毒素moxetumomab pasudotox等,亦在小规模临床试验中显示出对HCL患者的疗效。但是总体而言,目前新型药物对HCL患者的有效性结论,多来源于小规模前瞻性/回顾性研究,仍然需要在更大样本量的HCL患者人群中,验证新型药物的临床疗效和安全性。
所有作者声明无利益冲突



























