
总结儿童霍奇金淋巴瘤(HL)的临床特点及预后情况,分析儿童HL复发/进展的相关危险因素。
选择2008年1月1日至2019年12月31日四川大学华西第二医院收治的67例HL患儿为研究对象。患儿的中位发病年龄为9.1岁(6.0,11.6岁),男、女性患儿分别为52、15例。采用回顾性研究方法,收集患儿性别、年龄、肿瘤浸润部位、B组症状、巨大肿块、病理学类型、Ann Arbor分期、危险度分组、化疗方案等临床资料,采用χ2检验对不同临床特征患者的构成比进行比较。采用Kaplan-Meier法绘制总体生存(OS)和无事件生存(EFS)曲线,采用log-rank检验进行不同临床特征患儿生存率的比较,采用Cox比例风险回归模型对HL患儿OS和EFS的影响因素进行多因素分析。采用多因素非条件logistic回归分析对儿童HL复发/进展的影响因素进行多因素分析。本研究遵循的程序符合《世界医学协会赫尔辛基宣言》要求。
①本组67例HL患儿中,以男性(77.6%,52/67),年龄>7岁(70.1%,47/67),EB病毒编码的RNA(EBER)阳性(68.7%.46/67)为主,病理学类型主要为混合细胞型(54例,80.6%),主要浸润部位为颈部(80.6%,54/67)。②第2个疗程结束时,患儿完全缓解(CR)率为58.2%(39/67),部分缓解(PR)率为35.8%(24/67),疾病稳定(SD)率为4.5%(3/67),疾病进展(PD)率为1.5%(1/67),有效率为94.0%(63/67)。化疗结束时,CR患儿为64例(95.5%),PR为1例(1.5%),死亡为2例(3.0%)。③中位随访时间为55.6个月(26.8,99.4个月),5年OS和EFS率分别为84.6%和74.4%。单因素及多因素分析结果显示,伴B组症状、2个疗程内未达CR是影响HL患儿OS率(OR=11.281,95%CI:1.302~97.764,P=0.028;OR=14.091,95%CI:1.569~126.573,P=0.018)和EFS率(OR=6.470,95%CI:1.604~26.104,P=0.009;OR=6.834,95%CI:1.810~25.805,P=0.005)的独立危险因素。④复发/进展患儿中,伴B组症状和2个疗程未达CR患儿比例分别为78.6%(11/14)和100.0%(14/14),显著高于无复发/进展患儿的24.5%(13/53)和26.4%(14/53),并且差异均有统计学意义(χ2=14.070、24.651,P<0.001、0.001)。多因素非条件logistic回归分析结果显示,伴B组症状、2个疗程内未达CR是HL患儿发生复发/进展的独立危险因素(OR=6.233,95%CI:3.008~13.488,P=0.031;OR=9.403,95%CI:2.020~22.832,P<0.001)。
儿童HL高发于学龄期,以男性患儿多见,病理学类型以混合细胞型为主,常伴有EBV感染。早期治疗反应和伴B组症状可以预测HL患儿预后,并且提示高复发/进展风险。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
霍奇金淋巴瘤(Hodgkin lymphoma, HL)约占儿童恶性肿瘤的4.8%,HL患儿治疗后5年生存率可达98%[1]。与欧美国家相比,我国儿童HL发病率相对较低,<15岁儿童发病率仅为0.6×10-6[2]。目前国内儿童HL的治疗主要采用治疗成年人HL的MOPP(氮芥+长春新碱+甲基苄肼+泼尼松)方案和(或)ABVD(多柔比星+博来霉素+长春新碱+达卡巴嗪)方案等,Ⅰ~Ⅳ期患儿10年总体生存(overall survival,OS)率>90%,Ⅱ~Ⅳ期患儿的5年无事件生存(event free survival,EFS)率亦达80%,但是上述方案不但近期不良反应较多,并且远期随访时肌肉骨骼发育畸形、肺、心血管疾病、第二肿瘤发生率显著增高[3,4,5,6,7,8,9,10]。多项根据早期治疗反应及危险度分组进行分层治疗的临床研究结果显示,采用不同组合的化疗方案可使HL患儿5年OS率达到97.5%[11,12,13,14],因此儿童HL的临床治疗方案已经从采用成年人HL的ABVD方案逐渐转变为采用传统化疗方案的不同组合。目前国内关于儿童HL诊断、治疗的系统性临床研究仍较缺乏,本研究对四川大学华西第二医院血液科收治的67例HL患儿的临床特点、治疗及预后情况进行总结分析,旨在为优化规范儿童HL的临床诊治和预后改善提供参考。现将研究结果报道如下。
选择2008年1月1日至2019年12月31日四川大学华西第二医院收治的67例HL患儿为研究对象。其中,男、女性患儿分别为52、15例,性别构成比为3.5∶1;≤7岁患儿为20例(29.9%),>7岁为47例(70.1%),中位发病年龄为9.1岁(6.0,11.6岁),男、女性患儿中位发病年龄分别为9.3岁(5.7,12.2岁)和7.3岁(6.8,11.4岁)。本研究纳入标准:①年龄<18岁;②首次确诊为HL,既往未接受过相关治疗;③淋巴结病理活组织检查及免疫组织化学等检查资料完整;④于本院接受≥2个疗程规范治疗的患儿。排除标准:①合并严重脏器功能损害者;②继发性肿瘤者;③复发HL者;④既往已接受化疗或临床资料不完整者。本研究遵循的程序符合2013年修订版《世界医学协会赫尔辛基宣言》要求。
本研究所有HL患儿行病理组织形态学及免疫组织化学检查,并经三级甲等医院病理组织专家诊断确诊,诊断标准参照世界卫生组织(World Health Organization,WHO)2001病理分型标准[15]。HL临床分期采用Ann Arbor分期标准[16]。
根据中国抗癌协会小儿肿瘤专委会(Chinese Children Cancer Group,CCCG)制定的诊疗建议[12],将HL患儿分为低危、中危、高危。具体分组标准:低危为Ann Arbor ⅠA、ⅡA期且无巨大肿块;中危为Ann Arbor ⅠA、ⅡA期伴巨大肿块,ⅠB、ⅠAE、ⅡB、ⅡAE、ⅢA、ⅣA期伴或不伴巨大肿块;高危为Ann Arbor Ⅲ~Ⅳ期伴B组症状[6个月内体重减轻>10%和(或)发热>38 ℃和(或)夜间盗汗]。
本研究HL患儿根据CCCG-霍奇金病(Hodgkin disease,HD)-2004,德国儿科肿瘤和血液协会(German Pediatric Oncology and Hematology,GPOH)-HD-2002和CCCG-HD-2018方案进行治疗[12]。采用CCCG-HD-2004方案的HL患儿中,低危患儿给予COPP/ABV(环磷酰胺+长春新碱+甲基苄肼+泼尼松+多柔比星+博来霉素+长春碱)方案治疗4个疗程;中危给予COPP/ABV方案治疗6个疗程;高危采用A(阿糖胞苷/依托泊苷)、B(COPP/ABV)、C[CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)]方案交替进行,共计6个疗程。采用GPOH-HD-2002方案的患儿中,低危采用OEPA(长春新碱+依托泊苷+泼尼松+博来霉素)方案治疗4个疗程,中、高危患儿采用OEPA联合COPD(环磷酰胺+长春新碱+泼尼松+达卡巴嗪)方案治疗4~6个疗程。采用CCCG-HD-2018方案的HL患儿中,低危采用AV-PC(多柔比星+长春新碱+依托泊苷+泼尼松+环磷酰胺)方案治疗3个疗程,中危采用ABVE-PC(多柔比星+博来霉素+长春新碱+依托泊苷+泼尼松+环磷酰胺)方案治疗4个疗程。若2个疗程内未达完全缓解(complete remission,CR),低危患儿完成第3个疗程AV-PC方案后进行受累野小剂量放疗,中危完成6个疗程ABVE-PC方案后进行受累野小剂量放疗,高危患儿采用4个疗程ABVE-PC方案后均行受累野小剂量放疗,若2个疗程后未达CR则增加IFOS/VINO(异环磷酰胺+长春瑞滨)方案治疗2个疗程。治疗过程中发生复发/进展患儿,建议行自体造血干细胞移植(autologous stem cell transplantation,auto-HSCT)。
在治疗第2、4个疗程以及化疗结束时,根据患儿临床症状、体征、骨髓细胞形态学检查和影像学检查(PET/CT、彩色多普勒超声、CT或MRI)结果,判定HL患儿肿瘤大小及受累部位,并对其疗效进行评价[12]。疗效评价结果包括:CR,部分缓解(partial remission,PR),疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。有效率计算公式为:有效率(%)=(CR+PR患者)/同期患者总数×100%。
本研究采用电话、门诊复诊等方式对患儿进行随访。随访频率为:化疗休疗期门诊随访1次/周,停药后第1~2年每3个月1次,第3~5年每6个月1次,第5年后1次/年。随访时间截至2020年3月1日。OS期定义为从疾病确诊开始到末次随访的时间间隔;EFS期定义为从疾病确诊开始到末次随访,未发生进展、复发、失访、死亡等事件的时间间隔。治疗相关并发症主要包括生长发育、心、肺功能、内分泌功能的异常及发生第二肿瘤等。
采用回顾性研究方法,调查本组患儿的一般临床资料,包括性别、年龄、肿瘤浸润部位、B组症状、巨大肿块、病理学类型、Ann Arbor分期、危险度分组、化疗方案及组织病理学EB病毒(Epstein-Barr virus,EBV)编码的RNA(EBV-encoded RNA,EBER)等。
本研究所得数据采用SPSS 26.0统计学软件进行统计学处理。采用Ssize软件确定满足本研究统计检验的最小样本量。计数资料,如不同性别、年龄、Ann Arbor分期、病理学类型、危险度分组等不同临床特征患儿的构成比采用百分数(%)表示,不同类型患儿间构成比的比较采用χ2检验。采用Kaplan-Meier法分别绘制OS、EFS曲线。OS、EFS期采用M(Q1,Q3)表示。采用log-rank检验进行不同临床特征患儿生存率的比较,采用Cox比例风险回归模型对HL患儿OS和EFS的影响因素进行多因素分析。采用多因素非条件logistic回归分析对儿童HL复发/进展的影响因素进行分析。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
本组67例HL患儿中,以男性(77.6%,52/67),年龄>7岁(70.1%,47/67),EBER阳性(68.7%.46/67),Ann Arbor Ⅲ期(46.3%,31/67),以及中危患儿(44.8%,30/67)为主。患儿肿瘤主要浸润部位为颈部[54例(80.6%),其中10例患儿伴有发热、乏力、盗汗等症状],病理学类型以混合细胞型(54例,80.6%)为主,伴B组症状患儿为24例(35.8%),伴巨大肿块(肿瘤最大直径≥6 cm)患儿为20例(29.9%)。本研究67例HL患儿的一般临床资料,见表1。
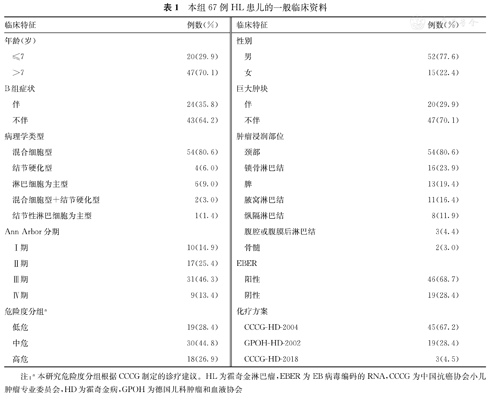
本组67例HL患儿的一般临床资料
本组67例HL患儿的一般临床资料
| 临床特征 | 例数(%) | 临床特征 | 例数(%) |
|---|---|---|---|
| 年龄(岁) | 性别 | ||
| ≤7 | 20(29.9) | 男 | 52(77.6) |
| >7 | 47(70.1) | 女 | 15(22.4) |
| B组症状 | 巨大肿块 | ||
| 伴 | 24(35.8) | 伴 | 20(29.9) |
| 不伴 | 43(64.2) | 不伴 | 47(70.1) |
| 病理学类型 | 肿瘤浸润部位 | ||
| 混合细胞型 | 54(80.6) | 颈部 | 54(80.6) |
| 结节硬化型 | 4(6.0) | 锁骨淋巴结 | 16(23.9) |
| 淋巴细胞为主型 | 6(9.0) | 脾 | 13(19.4) |
| 混合细胞型+结节硬化型 | 2(3.0) | 腋窝淋巴结 | 11(16.4) |
| 结节性淋巴细胞为主型 | 1(1.4) | 纵隔淋巴结 | 8(11.9) |
| Ann Arbor分期 | 腹腔或腹膜后淋巴结 | 3(4.4) | |
| Ⅰ期 | 10(14.9) | 骨髓 | 2(3.0) |
| Ⅱ期 | 17(25.4) | EBER | |
| Ⅲ期 | 31(46.3) | 阳性 | 46(68.7) |
| Ⅳ期 | 9(13.4) | 阴性 | 19(28.4) |
| 危险度分组a | 化疗方案 | ||
| 低危 | 19(28.4) | CCCG-HD-2004 | 45(67.2) |
| 中危 | 30(44.8) | GPOH-HD-2002 | 19(28.4) |
| 高危 | 18(26.9) | CCCG-HD-2018 | 3(4.5) |
注:a本研究危险度分组根据CCCG制定的诊疗建议。HL为霍奇金淋巴瘤,EBER为EB病毒编码的RNA,CCCG为中国抗癌协会小儿肿瘤专业委员会,HD为霍奇金病,GPOH为德国儿科肿瘤和血液协会
本研究完成所有化疗疗程患儿为65例(97.0%)。第2个疗程结束时,CR率为58.2%(39/67),PR率为35.8%(24/67),SD率为4.5%(3/67),PD率为1.5%(1/67),有效率为94.0%(63/67)。第4个疗程结束时,复发/进展患儿为4例,其中2例患儿(低危、高危各为1例)经过再次化疗后取得CR,2例患儿(均为高危)分别完成第4、5个疗程化疗后因感染性休克死亡。化疗结束时,CR患儿为64例(95.5%),PR为1例(1.5%)(高危),死亡为2例(3.0%)。5例CR患儿成功桥接auto-HSCT,1例PR患儿桥接auto-HSCT最终获得CR。
本研究对患者的中位随访时间为55.6个月(26.8,99.4个月)。截至随访结束,67例HL患儿的5年OS率为84.6%(图1A),5年EFS率为74.4%(图1B)。死亡患儿为8例(11.9%,包括化疗过程中死亡2例和随访过程中死亡6例),无病生存患儿为59例(88.0%),存活患儿均无第二肿瘤发生。与不伴B组症状和2个疗程内达CR的HL患儿相比,伴B组症状和2个疗程内未达CR患儿的5年OS率(94.1%比65.2%,100.0%比60.3%)和EFS率(91.7%比37.4%,100.0%比29.4%)显著下降,并且差异均有统计学意义(χ2=7.465、14.997、18.050、33.581, P=0.006、<0.001、<0.001、<0.001)。多因素分析结果显示,伴B组症状、2个疗程内未达CR是影响HL患儿OS率(OR=11.281,95%CI:1.302~97.764,P=0.028;OR=14.091,95%CI:1.569~126.573,P=0.018)和EFS率(OR=6.470,95%CI:1.604~26.104,P=0.009;OR=6.834,95%CI:1.810~25.805,P=0.005)的独立危险因素。本研究67例HL患者OS和EFS率影响因素的单因素和多因素分析结果,见表2,表3,表4。
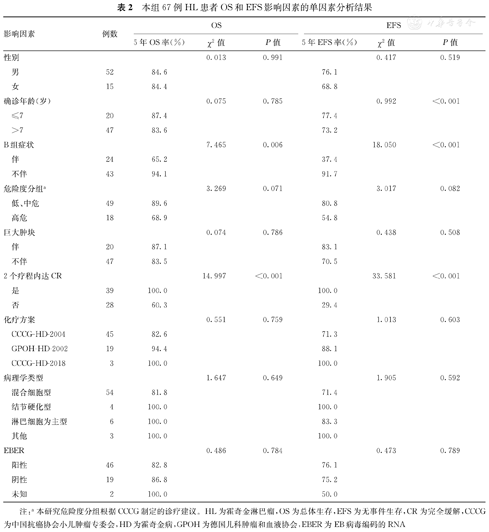
本组67例HL患者OS和EFS影响因素的单因素分析结果
本组67例HL患者OS和EFS影响因素的单因素分析结果
| 影响因素 | 例数 | OS | EFS | ||||
|---|---|---|---|---|---|---|---|
| 5年OS率(%) | χ2值 | P值 | 5年EFS率(%) | χ2值 | P值 | ||
| 性别 | 0.013 | 0.991 | 0.417 | 0.519 | |||
| 男 | 52 | 84.6 | 76.1 | ||||
| 女 | 15 | 84.4 | 68.8 | ||||
| 确诊年龄(岁) | 0.075 | 0.785 | 0.992 | <0.001 | |||
| ≤7 | 20 | 87.4 | 77.4 | ||||
| >7 | 47 | 83.6 | 73.2 | ||||
| B组症状 | 7.465 | 0.006 | 18.050 | <0.001 | |||
| 伴 | 24 | 65.2 | 37.4 | ||||
| 不伴 | 43 | 94.1 | 91.7 | ||||
| 危险度分组a | 3.269 | 0.071 | 3.017 | 0.082 | |||
| 低、中危 | 49 | 89.6 | 80.8 | ||||
| 高危 | 18 | 68.9 | 54.8 | ||||
| 巨大肿块 | 0.074 | 0.786 | 0.438 | 0.508 | |||
| 伴 | 20 | 87.1 | 83.1 | ||||
| 不伴 | 47 | 83.5 | 70.5 | ||||
| 2个疗程内达CR | 14.997 | <0.001 | 33.581 | <0.001 | |||
| 是 | 39 | 100.0 | 100.0 | ||||
| 否 | 28 | 60.3 | 29.4 | ||||
| 化疗方案 | 0.551 | 0.759 | 1.013 | 0.603 | |||
| CCCG-HD-2004 | 45 | 82.6 | 71.3 | ||||
| GPOH-HD-2002 | 19 | 94.4 | 88.1 | ||||
| CCCG-HD-2018 | 3 | 100.0 | 100.0 | ||||
| 病理学类型 | 1.647 | 0.649 | 1.905 | 0.592 | |||
| 混合细胞型 | 54 | 81.8 | 71.4 | ||||
| 结节硬化型 | 4 | 100.0 | 100.0 | ||||
| 淋巴细胞为主型 | 6 | 100.0 | 83.3 | ||||
| 其他 | 3 | 100.0 | 100.0 | ||||
| EBER | 0.486 | 0.784 | 0.473 | 0.789 | |||
| 阳性 | 46 | 82.8 | 76.1 | ||||
| 阴性 | 19 | 86.8 | 75.2 | ||||
| 未知 | 2 | 100.0 | 50.0 | ||||
注:a本研究危险度分组根据CCCG制定的诊疗建议。HL为霍奇金淋巴瘤,OS为总体生存,EFS为无事件生存,CR为完全缓解,CCCG为中国抗癌协会小儿肿瘤专委会,HD为霍奇金病,GPOH为德国儿科肿瘤和血液协会,EBER为EB病毒编码的RNA
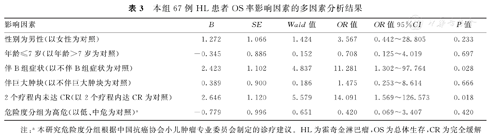
本组67例HL患者OS率影响因素的多因素分析结果
本组67例HL患者OS率影响因素的多因素分析结果
| 影响因素 | B | SE | Wald值 | OR值 | OR值95%CI | P值 |
|---|---|---|---|---|---|---|
| 性别为男性(以女性为对照) | 1.272 | 1.066 | 1.424 | 3.567 | 0.442~28.805 | 0.233 |
| 年龄≤7岁(以年龄>7岁为对照) | -0.345 | 0.886 | 0.152 | 0.708 | 0.125~4.019 | 0.697 |
| 伴B组症状(以不伴B组症状为对照) | 2.423 | 1.102 | 4.837 | 11.281 | 1.302~97.764 | 0.028 |
| 伴巨大肿块(以不伴巨大肿块为对照) | 0.389 | 0.900 | 0.186 | 1.475 | 0.253~8.614 | 0.666 |
| 2个疗程内未达CR(以2个疗程内达CR为对照) | 2.646 | 1.120 | 5.579 | 14.091 | 1.569~126.573 | 0.018 |
| 危险度分组为高危(以低、中危为对照)a | -0.779 | 0.996 | 0.651 | 0.420 | 0.069~3.407 | 0.420 |
注:a本研究危险度分组根据中国抗癌协会小儿肿瘤专业委员会制定的诊疗建议。HL为霍奇金淋巴瘤,OS为总体生存,CR为完全缓解
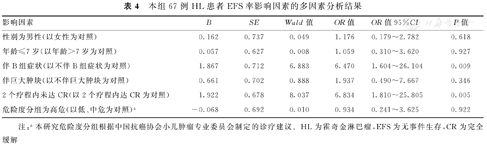
本组67例HL患者EFS率影响因素的多因素分析结果
本组67例HL患者EFS率影响因素的多因素分析结果
| 影响因素 | B | SE | Wald值 | OR值 | OR值95%CI | P值 |
|---|---|---|---|---|---|---|
| 性别为男性(以女性为对照) | 0.162 | 0.737 | 0.049 | 1.176 | 0.179~2.782 | 0.618 |
| 年龄≤7岁(以年龄>7岁为对照) | 0.057 | 0.627 | 0.008 | 1.059 | 0.310~3.620 | 0.927 |
| 伴B组症状(以不伴B组症状为对照) | 1.867 | 0.712 | 6.883 | 6.470 | 1.604~26.104 | 0.009 |
| 伴巨大肿块(以不伴巨大肿块为对照) | 0.661 | 0.702 | 0.888 | 1.937 | 0.490~7.667 | 0.346 |
| 2个疗程内未达CR(以2个疗程内达CR为对照) | 1.922 | 0.678 | 8.037 | 6.834 | 1.810~25.805 | 0.005 |
| 危险度分组为高危(以低、中危为对照)a | -0.068 | 0.692 | 0.010 | 0.934 | 0.241~3.625 | 0.922 |
注:a本研究危险度分组根据中国抗癌协会小儿肿瘤专业委员会制定的诊疗建议。HL为霍奇金淋巴瘤,EFS为无事件生存,CR为完全缓解
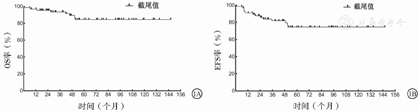

注:HL为霍奇金淋巴瘤,OS为总体生存,EFS为无事件生存
67例患儿中,无复发/进展患儿为53例(79.1%),复发/进展HL患儿为14例(20.9%,包括8例死亡患儿),中位复发时间为26.8个月(10.5,42.0个月)。复发/进展患儿中伴B组症状和2个疗程未达CR的患儿比例分别为78.6%(11/14)和100.0%(14/14),显著高于无复发/进展患儿的24.5%(13/53)和26.4%(14/53),并且差异均有统计学意义(χ2=14.070、24.651,P<0.001、0.001)。复发/进展和无复发/进展患儿临床特征的比较,见表5。多因素分析结果显示,伴B组症状、2个疗程内未达CR是HL患儿发生复发/进展的独立危险因素(OR=6.233,95%CI:3.008~13.488,P=0.031;OR=9.403,95%CI:2.020~22.832,P<0.001),见表6。
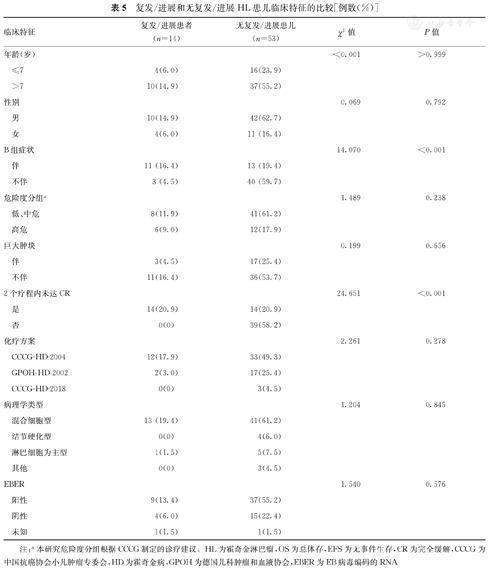
复发/进展和无复发/进展HL患儿临床特征的比较[例数(%)]
复发/进展和无复发/进展HL患儿临床特征的比较[例数(%)]
| 临床特征 | 复发/进展患者(n=14) | 无复发/进展患儿(n=53) | χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | <0.001 | >0.999 | ||
| ≤7 | 4(6.0) | 16(23.9) | ||
| >7 | 10(14.9) | 37(55.2) | ||
| 性别 | 0.069 | 0.792 | ||
| 男 | 10(14.9) | 42(62.7) | ||
| 女 | 4(6.0) | 11 (16.4) | ||
| B组症状 | 14.070 | <0.001 | ||
| 伴 | 11 (16.4) | 13 (19.4) | ||
| 不伴 | 3 (4.5) | 40 (59.7) | ||
| 危险度分组a | 1.489 | 0.238 | ||
| 低、中危 | 8(11.9) | 41(61.2) | ||
| 高危 | 6(9.0) | 12(17.9) | ||
| 巨大肿块 | 0.199 | 0.656 | ||
| 伴 | 3(4.5) | 17(25.4) | ||
| 不伴 | 11(16.4) | 36(53.7) | ||
| 2个疗程内未达CR | 24.651 | <0.001 | ||
| 是 | 14(20.9) | 14(20.9) | ||
| 否 | 0(0) | 39(58.2) | ||
| 化疗方案 | 2.261 | 0.278 | ||
| CCCG-HD-2004 | 12(17.9) | 33(49.3) | ||
| GPOH-HD-2002 | 2(3.0) | 17(25.4) | ||
| CCCG-HD-2018 | 0(0) | 3(4.5) | ||
| 病理学类型 | 1.204 | 0.845 | ||
| 混合细胞型 | 13 (19.4) | 41(61.2) | ||
| 结节硬化型 | 0(0) | 4(6.0) | ||
| 淋巴细胞为主型 | 1(1.5) | 5(7.5) | ||
| 其他 | 0(0) | 3(4.5) | ||
| EBER | 1.540 | 0.576 | ||
| 阳性 | 9(13.4) | 37(55.2) | ||
| 阴性 | 4(6.0) | 15(22.4) | ||
| 未知 | 1(1.5) | 1(1.5) |
注:a本研究危险度分组根据CCCG制定的诊疗建议。HL为霍奇金淋巴瘤,OS为总体存,EFS为无事件生存,CR为完全缓解,CCCG为中国抗癌协会小儿肿瘤专委会,HD为霍奇金病,GPOH为德国儿科肿瘤和血液协会,EBER为EB病毒编码的RNA
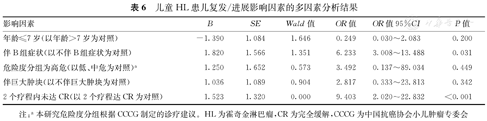
儿童HL患儿复发/进展影响因素的多因素分析结果
儿童HL患儿复发/进展影响因素的多因素分析结果
| 影响因素 | B | SE | Wald值 | OR值 | OR值95%CI | P值 |
|---|---|---|---|---|---|---|
| 年龄≤7岁(以年龄>7岁为对照) | -1.390 | 1.084 | 1.646 | 0.249 | 0.030~2.083 | 0.200 |
| 伴B组症状(以不伴B组症状为对照) | 1.820 | 1.566 | 1.351 | 6.233 | 3.008~13.488 | 0.031 |
| 危险度分组为高危(以低、中危为对照)a | 1.250 | 1.652 | 0.573 | 3.492 | 0.137~89.034 | 0.449 |
| 伴巨大肿块(以不伴巨大肿块为对照) | 1.036 | 1.089 | 0.904 | 2.817 | 0.333~23.813 | 0.342 |
| 2个疗程内未达CR(以2个疗程达CR为对照) | 1.523 | 1.320 | 0.000 | 9.403 | 2.020~22.832 | <0.001 |
注:a本研究危险度分组根据CCCG制定的诊疗建议。HL为霍奇金淋巴瘤,CR为完全缓解,CCCG为中国抗癌协会小儿肿瘤专委会
中国儿童HL发病率仅为欧美国家的1/10,属于相对罕见的儿童肿瘤。本研究纳入的67例儿童HL患儿中,中位发病年龄为9.1岁(6.0,11.6岁),最小发病年龄为3岁,男女性别比例为3.5∶1,与国外报道基本一致[8,9,10,17]。
儿童HL的病理学类型常以结节硬化型及混合细胞型多见。本研究67例HL患儿的病理学类型以混合细胞型最为多见,占80.6%(54/67)。段彦龙等[13]研究亦发现,HL患者病理学类型中结节硬化型发生率最高,约为43%,但该类型好发于年轻成年人,而混合细胞型发生率约为24%,该类型则更好发于≤10岁儿童。这一病理学类型分布特点可能与我国HL患儿中EBV感染率较高有关[18]。在经典型HL患者中,EBER阳性在低年龄以及混合细胞型HL中更为常见[19,20]。EBV通过其编码的潜伏膜蛋白(latent membrane protein,LMP)1和EBV核抗原(EBV nuclear antigen,EBNA)等发挥诱导转化作用,促使静止的B细胞转化成克隆性HRS(Hodgkin/Reed-Sternberg)细胞,同时产生免疫逃逸,最终导致HL发生[20]。本研究中,组织病理学EBER阳性患儿比例为68.7%(46/67),这可能是导致本组HL患儿混合细胞型比例较高的原因。本组67例HL患儿以无痛性、进行性肿大的颈部包块[80.6%(54/67)]起病者最为常见,锁骨区淋巴结、脾、腋窝淋巴结区域也是肿瘤浸润较为多见的部位。本研究中35.8%(24/67)HL患儿初诊时伴B组症状,与国内、外研究结果基本一致[5,13]。本组患儿的危险度分组以中危者比例最高[44.8%(30/67)],临床分期则以Ⅲ~Ⅳ期最多见[59.7%(40/67)],并且高于国外临床研究的19%~35.3%[3,6]。上述临床特点可能与HL患儿以无痛包块起病未引起家长重视,以及国内儿童血液/肿瘤专科医师数量相对仍较少而未早期诊断有关。
本研究45例采用CCCG-HD-2004方案治疗患儿的5年OS率为82.6%,5年EFS率为71.3%,低于国内其他研究[13]。究其原因,可能跟西南地区HL患儿家庭经济条件有限、治疗依从性不高有关。19例采用GPOH-HD-2002方案治疗患儿的5年OS率为94.4%,5年EFS率为88.1%,与国外研究结果一致[7],而采用GPOH-HD-2002方案者的5年OS及EFS率略高于CCCG-HD-2004方案,但3种方案总体差异无统计学意义(P=0.759)。此外,本研究是在不同阶段分别采用CCCG-HD-2004方案(2008-2015年)和GPOH-HD-2002方案(2016-2019年),而近年来疾病随访手段的多样性及患儿治疗依从性的不断提高亦有利于延长患儿生存率。本研究仅3例患儿使用了CCCG-HD-2018方案,因此其疗效仍有待扩大样本量进一步研究证实。
目前,疾病晚期、伴巨大肿块及B组症状既往被认为是HL的预后不良因素[6]。本研究结果显示,2个疗程内达CR患儿的5年OS率和EFS率均为100.0%,显著高于2个疗程内未达CR者的60.3%和29.4%,差异有统计学意义(χ2=14.997、33.581, P<0.001、0.001)。这表明早期治疗反应与HL患儿的预后密切相关,该结果在其他研究中得到印证[21,22,23],并且在上述结论的基础上结合PET/CT分期对HL患儿进行危险度分组并实施分层治疗是近年来的相关研究热点。伴B组症状也是影响儿童HL预后的不良因素,本研究结果显示,伴B组症状HL患儿的5年OS率和EFS率分别为65.2%和37.4%,显著低于不伴B组症状者的94.1%和91.7%,差异有统计学意义(χ2=7.465、18.050, P=0.006、<0.001),这与Karhan等[22]研究结果相符。虽然伴巨大肿块的HL患儿5年OS、EFS率较未伴巨大肿块者低,但差异无统计学意义(P=0.786)。目前成年人HL中已建立了成熟的预后评分系统,但是儿童HL的预后评估仍较困难,尽管美国儿童肿瘤协作组(Children′s Oncology Group, COG)已建立了儿童HL预后评分系统,其仅针对中危HL患儿,基于疾病分期、纵隔肿块大小、发热、血清白蛋白以预测诊断HL后4年的EFS[6],但是该系统由于限制因素较多而未被广泛使用。因此,建立统一、成熟的儿童及青少年HL的预后评分系统,可能成为该方面未来的研究方向。
本研究67例HL患儿中,复发/进展患儿为14例(20.9%,包括8例死亡患儿);复发/进展患儿中,伴B组症状和2个疗程内未达CR患儿比例为78.6%(11/14)和100.0%(14/14),显著高于无复发/进展组的24.5%(13/53)和26.4%(14/53),并且差异均有统计学意义(P<0.05);多因素分析结果显示,伴B组症状、2个疗程内未达CR均是HL患儿发生复发/进展的独立危险因素(OR=6.233,95%CI:3.008~13.488,P=0.031;OR=9.403,95%CI:2.020~22.832,P=0.000)。这提示,对于伴B组症状且早期治疗效果不佳的HL患儿出现疾病复发和进展的可能性较高。目前auto-HSCT是难治/复发HL患儿最常用的治疗手段,治疗后5年OS为43%~95%[24],异基因造血干细胞移植在复发/进展HL的治疗中应用则较少。而免疫治疗、靶向治疗的应用,使得复发/进展HL患儿的5年OS率从1988-2001年的(62.5±9.6)%提高至2002-2015年的(91.8±4.4)%,5年EFS率从(41.7±9.6)%提高至(87.7±5.3)%[24]。此外,CD30抗体在成年人及儿童、青少年、年轻成年人的复发/进展HL临床研究中亦显示出较好的临床疗效[25,26]。程序性细胞死亡蛋白(programmed cell death protein,PD)-1抗体药物纳武单抗(nivolumab)和帕博利珠单抗(pembrolizumab)及程序性细胞死亡配体(programmed cell death ligand,PD-L)1药物阿替利珠单抗(atezolizumab)已被FDA批准上市,其用于经预处理的HL患儿可能取得较高的有效率[27,28]。但是本研究中,由于受到患儿家庭经济条件及家属依从性等因素的制约,复发/进展患儿未进行PD1/PDL-1、CD20、CD30等靶点检测而未使用靶向治疗药物。未来本中心将进一步完善复发/进展HL患儿的相关靶点检测,以指导临床个体化制订新的挽救治疗策略,改善患儿预后。美国食品药品监督管理局(Food and Drug Administration,FDA)
总而言之,儿童HL高发于学龄期,男性多于女性,常伴有EBV感染,病理类型以混合细胞型为主。该病进展缓慢、肿瘤浸润广泛,但疾病预后较好,即使发生复发/进展,仍可取得较高的CR率,采用基于包含早期治疗反应和B组症状的评分系统进行危险度分组,并采用联合化疗、低剂量放疗、auto-HSCT以及靶向药物,可能延长患儿生存期。尽管儿童HL整体预后较好,但是复发/进展HL患儿的预后仍待提高,而不同组合新治疗方案的有效性及安全性,亦有待进一步研究证实。
所有作者声明无利益冲突



























