
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肥厚型心肌病(hypertrophic cardiomyopathy,HCM),是一种以左心室肥厚为突出特征的原发性心肌病,是最常见的遗传性心脏病,也是青少年和运动员发生心脏性猝死(sudden cardiac death,SCD)的首要原因[1,2,3,4,5,6]。对HCM的现代研究始于20世纪60年代[7,8],经过近60年发展,如今在流行病学、遗传学、影像学及临床诊断、治疗和预防等方面均取得了巨大进展[9]。基因检测技术的快速发展,使得对该病的认识已从临床水平进入基因水平[10]。
我国目前尚缺乏HCM管理指南,10年前发表的《心肌病诊断与治疗建议》涉及HCM内容,但已不能满足当前临床需要[11]。为此,我们组织了专门从事HCM研究的专家分析现有资料,借鉴欧美关于心肌病定义和分类的报告和科学声明[1,2,3]以及专门针对HCM的专家共识和指南[4,5,6],并结合我国研究成果,制定本指南,旨在规范HCM的诊断和治疗,帮助临床医师做出决策。
本指南采用国际通用方式,对每种诊疗措施均标明了其推荐类别和证据水平分级:Ⅰ类推荐指已证实和(或)一致公认某治疗措施或操作有益、有效,应该采用;Ⅱ类推荐指某治疗措施或操作的有效性尚有争论,其中Ⅱa类推荐指有关证据和(或)观点倾向于有效,应用该治疗措施是适当的,Ⅱb类推荐指有关证据和(或)观点尚不能证明有效,需进一步研究;Ⅲ类推荐指已证实和(或)一致公认某治疗措施或操作无用和(或)无效,并对某些病例可能有害,不推荐使用。证据水平A级指资料来源于多项随机临床试验或荟萃分析;B级指资料来源于单项随机临床试验或多项大规模非随机对照研究;C级指资料来源于专家共识和(或)小型临床试验、回顾性研究或注册登记。由于HCM的随机对照研究很少[12],本指南中关于HCM的诊治建议大多依据队列研究和专家共识意见(证据水平为B级或C级)。
HCM是一种原发性心肌病,主要由基因突变引起,临床表现为左心室明显肥厚,通常不伴有左心室腔的扩大(正常或缩小),需除外其他可引起心室壁增厚的生理因素、心血管疾病或全身性疾病。
HCM主要是一种常染色体显性遗传性心脏病,在青少年和成人HCM中,40%~60%是由编码心肌肌小节蛋白的基因突变引起,5%~10%是由其他基因突变或非遗传疾病引起,另外还有25%~30病因不明[6,10]。
自从首次发现编码心肌肌小节β肌球蛋白重链基因(MYH7)第13号外显子错义突变以来[21],迄今已至少在27个编码心肌肌小节粗肌丝、细肌丝结构蛋白及Z盘蛋白的基因中发现与HCM相关的突变(>1500个),其中,MYH7基因和肌球蛋白结合蛋白C基因(MYBPC3)突变是最常见的两种致病基因突变(占50%~70%)。这些致病基因的突变形式绝大多数为错义突变(约占90%)[10],尤其MYH7基因,但MYBPC3基因突变形式多种多样[10]。
与没有基因突变的患者相比,肌小节蛋白基因突变患者发病年龄更小、左心室壁更厚,HCM及SCD家族史发生率更高[22]。突变阳性患者往往存在更严重的微血管功能障碍和心肌纤维化[23]。约5%患者存在双突变或多突变(至少2个相同或不同基因的突变),这些患者往往发病更早,表型更严重[24,25,26]。
国内对汉族成人HCM患者采用直接DNA测序技术结果显示,3种常见突变基因MYH7、MYBPC3、肌钙蛋白T基因(TNNT2)的频率分别为26%~35%、18%~56%和4%~13%,其中2.2%~3.5%的患者带有双突变或多突变[27,28,29]。
心脏重量增加、心室壁增厚、左心室腔变小和左心房扩大。
心肌细胞肥大、心肌细胞排列紊乱、间质纤维化及心室壁内冠状动脉(冠脉)异常(表现为管壁增厚、管腔变小等)。
肌小节结构异常、肌原纤维排列失去同向性和细胞器数量增多。
HCM具有复杂的病理生理机制,有多种相互作用的机制参与。
多为不均衡的局部性增厚,位于室间隔上部、主动脉瓣下的心内膜,称为非对称性室间隔肥厚。心室壁增厚是HCM的重要病理生理机制,超声心动图是其首选评价方法。
主要包括间质性纤维化和修复性(替代性)纤维化(即瘢痕)两种类型,此外还有小血管周围纤维化和丛状纤维化。诊断心肌纤维化的金标准是组织病理学检查,心脏磁共振成像(cardiac magnetic resonance imaging,CMRI)是目前检测心肌纤维化首选无创影像学方法。
病因主要包括心肌细胞肥大导致氧供和需求失衡以及心室壁内冠脉结构异常引起冠脉微血管功能障碍。此外,部分患者合并冠脉肌桥及心外膜冠脉病变,也是心肌缺血的重要病因。单光子发射计算机断层(single photon emission computed tomography imaging, SPECT)负荷/静息心肌灌注显像是目前评价心肌缺血的有效方法。
心肌缺血、缺氧、能量代谢障碍,导致心肌主动松弛能力受损;心室肥厚、心肌纤维化、心室几何形状改变等,导致心室壁顺应性降低(僵硬度增加),心室被动充盈过程受限,共同导致心室舒张功能异常。多普勒超声心动图检查是目前评价左心室舒张功能最常用方法。
根据静息状态或激发试验时左心室流出道的瞬时峰值压差(left ventricular outflow tract gradient,LVOTG)≥30 mmHg(1 mmHg=0.133 kPa)定义为LVOTO。原因包括室间隔上段、主动脉瓣下区心内膜的异常肥厚形成的机械性梗阻及二尖瓣前叶收缩期接近室间隔基底产生的动力性梗阻。
HCM患者常合并二尖瓣关闭不全,并参与LVOTO形成。多数是由于SAM征象所致,部分合并二尖瓣自身器质性病变。LVOTO、SAM征象和二尖瓣关闭不全,三者关系密切。
HCM是一种具有高度异质性的心脏疾病,应对患者进行全面的临床评估。
对诊断及危险分层非常重要。有意义家族史包括SCD、心力衰竭、心脏移植以及植入式心脏转复除颤起搏器(implantable cardioverter defibrillator,ICD)治疗史。
HCM患者临床症状主要包括呼吸困难、胸痛、心悸、晕厥,少数发生SCD,也有相当一部分患者没有任何症状。
多数患者可出现劳力性呼吸困难,主要与心室舒张功能异常相关。
部分患者有劳力性胸痛症状,与心肌缺血相关,但多数冠脉造影正常,SPECT负荷/静息心肌灌注显像有心肌缺血表现。
患者可出现多种心律失常,如:阵发性室上性心动过速、心房颤动(房颤)、非持续性室性心动过速、心脏传导阻滞等。
15%~25%HCM患者至少发生过一次晕厥或近似晕厥[30]。原因主要为心律失常和血流动力学异常(LVOTO和运动血压反应异常)。
肥厚型梗阻性心肌病患者胸骨左缘第3~4肋间可闻及较粗糙的喷射性收缩期杂音,不向颈部传导,增加心肌收缩力或减轻心脏前后负荷的措施(如强心药、站立位、Valsalva动作、含服硝酸甘油等)可使杂音增强;相反,减弱心肌收缩力或增加心脏前后负荷措施(如β受体阻滞剂或蹲位、抬腿等)可使杂音减弱。需要与主动脉瓣狭窄和二尖瓣关闭不全杂音相鉴别。
HCM患者心脏一般不大,终末期HCM表现为左心或全心明显增大,伴左心衰竭时两肺可闻及细湿啰音,伴右心衰竭时可有下肢凹陷性水肿。此外,左房强有力收缩可出现第四心音,心室强有力收缩可产生特异性心尖部双重搏动,但并不常见。
HCM患者需要通过以下检查进行全面的临床评估。
包括常规12导联心电图和24~48 h动态心电图(Holter)。
有助于协助诊断并提供病因线索,建议所有HCM患者行12导联心电图检查(Ⅰ类推荐,B级证据,简称Ⅰ类,B级)。一项研究显示,HCM患者首次就诊时94%存在心电图异常,包括左心室高电压、病理性Q波及ST-T改变,只有6%心电图正常[33]。
包括经胸超声心动图(transthoracic echocardiography,TTE)、经食管超声心动图(transesophageal echocardiography, TEE)及心肌声学造影(myocardial contrast echocardiography,MCE)。超声心动图检查具有快速、便捷及实时动态操作等优势,是HCM患者诊断、病情监测、治疗方法选择及治疗效果评估的首选检查方法[36,37]。
(1)测量心室壁厚度:应该测量舒张末期心室短轴从心底至心尖所有节段心室壁最大厚度(Ⅰ类,C级),评价心室壁增厚程度及部位,避免心室长轴M型超声斜切而高估心室壁厚度。这是诊断HCM首选的影像学检查方法。(2)评价LVOTO[38,39]:所有确诊HCM患者测量静息和Valsalva动作时(坐位、半仰卧位和站立位)LVOTG(Ⅰ类,B级)。静息或激发后LVOTG<50 mmHg的有症状患者,建议超声运动负荷试验,检测运动诱发的LVOTO和二尖瓣反流(Ⅰ类,B级)。无症状患者不常规行超声运动负荷试验(Ⅱb,C级)。不建议多巴酚丁胺药物激发试验,不能行运动激发试验者考虑硝酸酯药物激发试验。(3)评价二尖瓣及瓣下相关结构:除SAM征象,其他结构异常如:二尖瓣叶拉长和乳头肌移位等,也参与LVOTO形成,超声心动图检查有助于明确LVOTO机制及程度。(4)左心房扩大:由多因素引起,SAM征象相关的二尖瓣反流和左心室充盈压升高是最常见原因。左心房内径[40]和左心房容积指数[41]与HCM患者预后有关。(5)评价心室舒张功能:包括脉冲多普勒测量二尖瓣血流、组织多普勒测量二尖瓣环速度、肺静脉血流速度、肺动脉收缩压以及左心房大小和容积(Ⅰ类,C级)[42],需要多参数综合分析。(6)评价心室收缩功能:左心室射血分数(left ventricular ejection fraction, LVEF)不是评价HCM患者左心室收缩功能的良好指标。目前通过多普勒心肌显像或斑点追踪技术获得心肌纵向速度和变形参数(应变和应变率)可以较准确地评估左心室收缩功能[43]。
可提供关于心脏形状、心室功能及心肌组织特性等多方面详细信息,克服了超声心动图检查的诸多限制,是目前诊断HCM最准确的检查方法[48,49]。建议由在心脏成像及心肌病评估方面有经验的团队开展CMRI检查并对结果进行解读(Ⅰ类,C级)。
CMRI在HCM中应用主要包括:(1)评价心室形态和功能:对左心室前侧壁、心尖部和右心室肥厚及心尖部室壁瘤和血栓的检测,CMRI检查优于超声心动图检查[50,51,52]。怀疑HCM患者首次就诊时建议完善CMRI检查明确诊断(Ⅰ类,B级)。怀疑心尖肥厚或室壁瘤患者行CMRI检查有助于明确诊断(Ⅱa类,C级)。(2)评价心肌纤维化:CMRI检查是目前临床评估心肌纤维化首选的无创性影像学方法[53]。钆对比剂延迟强化(late gadolinium enhancement,LGE)技术可有效评价心肌局限的替代性纤维化(瘢痕)。大约65%(范围33%~84%)HCM患者出现LGE,多表现为肥厚心肌内局灶性或斑片状强化,以室间隔与右心室游离壁交界处局灶强化最典型。存在LGE与非持续性室性心动过速发生相关,与HCM患者不良预后相关[54,55]。因此,CMRI-LGE(定性)有助于HCM患者危险分层及预后判断,对HCM诊断明确且无禁忌证患者考虑行CMRI-LGE检查(Ⅱa类,B级),评价心脏解剖、心室功能、是否存在心肌纤维化及程度。室间隔消减治疗前也可考虑CMRI-LGE检查,评价心肌肥厚和纤维化程度及分布(Ⅱb类,C级)。CMRI-LGE还有助于与其他引起心室壁肥厚的疾病相鉴别,如心内膜下弥漫性甚至透壁性强化是心肌淀粉样变的典型特征[56],怀疑心肌淀粉样变的患者应该考虑行CMRI-LGE检查(Ⅱa类,C级)。
近年出现的心脏磁共振纵向弛豫时间定量成像(T1 mapping)技术[57]可评估心肌弥漫间质纤维化,可作为常规LGE的重要补充或替代。
包括平板运动试验、超声运动负荷试验及心肺运动试验。
主要监测HCM患者是否存在运动血压反应异常,有助于SCD危险分层(Ⅱa类,B级)。运动血压反应异常定义为运动高峰收缩压上升<20 mmHg,或收缩压下降>20 mmHg。20%~40%成年HCM患者存在运动血压反应异常,与SCD发生风险增加相关,尤其是年龄≤40岁患者。
用于筛查隐匿肥厚型梗阻性心脏病,即静息LVOTG<30 mmHg,激发LVOTG≥30 mmHg。
目前主要利用SPECT负荷/静息心肌灌注显像评价心肌缺血,适用于存在胸部不适但冠心病低度可能的HCM患者(Ⅱa类,C级)[62],以除外合并冠心病。
心脏CT检查应用于超声图像差而CMRI检查禁忌的HCM患者(Ⅱa类,C级),不仅可以了解心脏结构和功能,还可以提供冠脉和心脏瓣膜信息,协助诊断冠心病和瓣膜病[63]。
HCM患者行冠脉造影检查目的主要包括两方面:(1)协助诊断:成年心脏骤停,或持续性室性心动过速,或稳定型心绞痛[加拿大心血管学会(CCS)分级≥3级]患者建议行冠脉造影检查(Ⅰ类,C级)。HCM患者根据其年龄、性别以及其他危险因素判定冠心病中度可能,或有冠脉血运重建病史,出现劳力性胸痛(CCS分级<3级),可考虑行冠脉造影或CT检查(Ⅱa类,C级)。(2)指导治疗:年龄≥40岁的肥厚型梗阻性心肌病患者在室间隔消减治疗前,无论是否存在劳力性胸痛,都应考虑冠脉造影(或CT)检查(Ⅱa类,C级),了解冠脉情况(尤其是间隔支动脉解剖结构),确定治疗措施。
可以显示左心室收缩期和舒张期形态,测量左心室舒张末压以及连续测量左心室至升主动脉的压力。HCM患者左心室造影特点如下:(1)形态改变:HCM患者由于病变部位以及程度不同,左心室造影时形态改变各不相同。心尖HCM患者左心室舒张期形态呈"黑桃尖形"或"铲状"[64,65],左心室中部肥厚型梗阻性心肌病患者左心室收缩期形态呈"沙漏形"或"哑铃状"[66,67]。(2)左心室压力变化:左心室测压显示左心室舒张末压升高,提示左心室舒张功能不全。左心室至升主动脉连续测压有助于鉴别肥厚型梗阻性心肌病与主动脉瓣狭窄,前者左心室腔与流出道间存在压差,后者左心室与主动脉间存在压差。
包括右心导管和左心导管检查,主要用于以下两种情况:(1)接受心脏移植或机械循环支持的患者,评价右心和左心功能及肺动脉阻力(Ⅰ类,B级)[68]。(2)无创心脏影像学检查结果不明确的有症状患者,用来评价LVOTO严重程度,测量左心室充盈压(Ⅱb类,C级)[69]。
主要用于以下两种情况:(1)证实有持续或反复室上性心动过速以及心室预激的患者,建议电生理检查并治疗可消融基质(Ⅰ类,C级)。(2)部分明确、有症状、单形、持续性室性心动过速(>30 s)患者可考虑行电生理检测并治疗可消融基质(Ⅱb类,C级)。
属有创检查项目,仅临床评估提示存在心肌浸润(如心肌淀粉样变)、沉积(如糖原储积症)或炎症(如巨细胞心肌炎),而其他检查方法不能明确时(Ⅱb类,C级)进行,有助于HCM的鉴别诊断[70]。
家族性HCM通常为常染色体显性遗传,子代有50%概率遗传到该致病突变基因,但具有不同的基因表现度和年龄相关的外显率[10]。个别散发HCM患者的父母无HCM临床表现,原因可能是由于患者携带突变基因为"原始(de novo)突变",或者基因外显率低,还有少见原因是该家系致病突变遗传方式为常染色体隐性遗传。大约60%的HCM患者可找到明确的致病突变基因,有家族史的患者突变基因检出率最高,而老年及表现不典型患者基因检出率最低。
所有不能用非遗传因素全部解释的HCM患者,建议行遗传咨询(Ⅰ类,B级),收集其他家族成员与HCM相关的信息,绘制详细的家系图,明确可能的遗传方式。咨询辅导应该由经过培训的专业人士进行多学科联合工作(Ⅱa类,C级),帮助患者了解和处理遗传病的心理、社会、职业、伦理和法律等问题[73]。
既往筛查方法主要是首先通过临床表现、家系分析等初步锁定该先证者可能的"致病基因",然后对"候选基因"进行一代测序。但测序技术成本高、速度慢及低检出率,限制了临床应用。目前,新的高通量测序技术,又称为二代测序技术出现,可以实现全外显子组测序甚至全基因组测序,显著提高先证者致病突变基因的检出率,降低筛查成本[74]。不管采用何种筛查方法,突变的解释应该遵循遗传检测和诊断测试的通用原则,在有资质的实验室开展,采用经过认证的基因分析和报告系统。
先证者致病基因突变的确认,有助于家族成员中HCM患者的早期诊断、临床监测和优生优育,因此,建议所有确诊患者进行遗传检测(Ⅰ类,B级),决定是否对家族成员进行逐层遗传筛查。建议在有心肌病相关突变解读专家的有资质的实验室进行(Ⅰ类,C级)。
如果患者存在能够提示HCM特定病因的疾病症状和体征,建议进行遗传检测以明确诊断(Ⅰ类,B级)。对于处在HCM诊断临界状态(成人左心室壁厚度12~13 mm,或者左心室肥厚伴有高血压、瓣膜病及运动员)患者,应该在专家团队仔细评估后进行遗传检测(Ⅱa类,C级)。对病理确诊的HCM,已经死亡患者存储的组织或外周血DNA,应考虑进行遗传检测,以帮助对其亲属进行逐层遗传筛查(Ⅱa类,C级)[75]。
先证者致病基因突变已经明确的家系,建议所有亲属在遗传咨询后进行遗传检测(Ⅰ类,B级)。若携带与先证者相同的明确致病突变基因,则进行包括心电图和超声心动图检查及长期随访在内的临床评估(Ⅰ类,C级);若未携带与先证者相同的明确致病突变基因,则无需后续随访,但如果之后出现症状或该家系出现新的临床相关数据,建议对其再次进行评估(Ⅱa类,B级)。这种遗传+临床筛查模式不仅能更早诊断患病亲属,还可以让非患病且不携带致病突变基因的亲属免于长期随访。
先证者未行遗传检测或未明确致病基因突变的家系,建议成年一级亲属首先进行心电图和超声心动图检查的临床评估(Ⅱa类,C级),而不是遗传检测。因HCM致病基因外显率随着年龄增高而上升,一次表型阴性不能保证无发病可能,所以亲属的临床评估需长期反复进行,每2~5年重复一次。
父母携带明确致病突变基因的儿童,考虑在10岁时或以后进行遗传检测,检查标准应该与国际儿童遗传检测指南保持一致(Ⅱa类,C级)。对遗传状态不明的10岁及以上儿童一级亲属,应考虑10~20岁间每1~2年,20岁以后每2~5年进行一次心电图和超声心动图检查的临床评估(Ⅱa类,C级)。如果父母或法定监护人要求,可在遗传检测前行心电图和超声心动图检查的临床评估,或者以临床评估取代遗传检测(Ⅱb类,C级)。如果该家系有童年阶段或疾病早发的恶性家族史,或儿童出现心脏症状,或儿童需要参加剧烈体育活动,可以考虑对儿童一级亲属在10岁以前进行临床或遗传检测(Ⅱb类,C级)。
突变基因携带者心室形态和功能可有轻度异常,但临床意义不明。SCD很少发生在无心肌肥厚的携带者中。因此,多数无表型突变基因携带者临床预后良好。但由于HCM致病基因突变存在年龄相关的外显率[80],对无表型突变基因携带者仍应该长期随访,以早期发现临床表型。
成人左心室壁厚度正常上限为12 mm,右心室壁厚度上限为4 mm。心室壁增厚是诊断HCM的必备条件,可以采用多种不同心脏影像学检查方法,如超声心动图、CMRI或CT。在某些情况下还需要基因检测协助诊断。
定义为并非完全因心脏负荷异常引起的心室壁增厚,任意心脏影像学检查发现一个或多个左心室心肌节段室壁厚度≥15 mm。右心室肥厚诊断标准为右心室壁最大厚度≥8 mm。其中,左心室壁最大厚度≥30 mm称为极度左心室肥厚,右心室壁最大厚度≥10 mm称为极度右心室肥厚[81,82]。
部分家族性或散发的HCM患者左心室壁厚度在13~14 mm之间,不能轻易否定其为HCM可能,需综合评价后明确诊断。一些特殊人群,如:首发表现为左心室扩大、室壁变薄、收缩功能降低等终末期心力衰竭特征的HCM患者、孤立性室间隔基底段增厚的老年患者、高强度训练引起的生理性肥厚及合并高血压、瓣膜病等心脏后负荷病理性增加患者,临床无法明确诊断时需要行基因检测。
确诊HCM患者的一级亲属临床诊断HCM的标准是存在不能用其他原因解释的左心室壁增厚,任意心脏影像学检查发现一个或多个左心室心肌节段室壁厚度≥13 mm。
左心室壁厚度增加超过同年龄、性别或体表面积儿童左心室壁厚度平均值2倍以上标准差,即:Z值(定义为偏离人群正常值的标准差数)>2时,诊断为HCM。儿童严重左心室肥厚的诊断标准为Z值≥6[83]。
指除先证者外,三代直系亲属中有两个或以上成员被诊断为HCM,或者存在与先证者相同的基因突变位点,伴或不伴有心电图及超声心动图异常者,可诊断为家族性HCM,否则为散发性HCM。
心室壁增厚是HCM的典型特征,但有多种生理性和病理性因素可导致心室壁增厚,因此,在临床诊断HCM前需除外其他心血管疾病或系统性疾病。
长期锻炼可以使心脏发生适应性心肌肥厚改变,表现为对称性左心室肥厚,一般心室壁厚度12~16 mm,伴左心室扩大(左心室舒张末期内径55~66 mm),但左心房不扩大,左心室舒张功能正常,无心肌病家族史,基因检测阴性。停止运动3个月后心脏可以缩小,心肌肥厚可以减轻。
长期高血压可导致心肌肥厚,一般表现为左心室壁弥漫、均匀性(对称性)增厚,程度相对较轻,有时伴左心室腔扩大,可同时合并肾脏、脑血管及眼底高血压改变。严格控制血压(收缩压<130 mmHg)6~12个月后左心室肥厚可以减轻。
主动脉瓣狭窄可引起心脏后负荷增加,导致心肌发生代偿肥厚,其症状和杂音与HCM相似,但有如下特点:(1)主动脉瓣狭窄的收缩期杂音位置较高,以胸骨右缘第2肋间和胸骨左缘第3肋间明显,杂音向颈部传导,改变心脏前后负荷措施对杂音强度影响不大。(2)胸部X线显示升主动脉扩张,主动脉瓣可有钙化影。(3)超声心动图检查可见主动脉瓣叶明显增厚、收缩期开放受限,瓣口面积明显缩小。(4)左心导管检查提示左心室与左心室流出道之间无压差存在,而左心室与主动脉之间有明显的收缩期压差。
是指淀粉样物质在心肌细胞外基质沉积,导致心室壁假性肥厚引起的一类疾病。心电图特点为肢体导联低电压、房颤;超声心动图表现为心室壁增厚,心肌回声增强,可见颗粒状回声,伴左心室舒张功能障碍;CMRI表现为心内膜下弥漫性甚至透壁性(全层)强化。心内膜心肌活检组织刚果红染色阳性且偏光显微镜下呈苹果绿双折射为诊断心肌淀粉样变的金标准。淀粉样蛋白免疫组化分型有助于明确其亚型,常见的有AL型(又称原发性心肌淀粉样变,淀粉样物质为免疫球蛋白轻链)、遗传性ATTR型(淀粉样物质为突变的转甲状腺素蛋白TTR)和老年系统性淀粉样变(淀粉样物质为野生型TTR)。
此外,HCM患者还需要与其他代谢疾病、神经肌肉疾病等相鉴别[85],如Anderson-Fabry病、Danon病、Pompe病、Friedreich共济失调、线粒体心肌病等。
HCM患者诊断流程见图1。
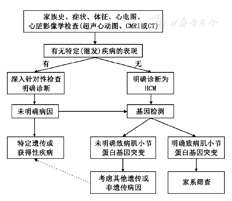

注:CMRI:心脏磁共振成像,CT:计算机断层成像,HCM:肥厚型心肌病
根据血流动力学、肥厚部位以及遗传学规律,HCM可分为不同的临床类型。
指异常肥厚心肌突入左心室腔,造成血流通道阻塞,并在其上下方产生压力阶差。根据梗阻部位可分为LVOTO、中部梗阻及心尖部梗阻,与心室壁肥厚部位有关。
通常所说肥厚型梗阻性心肌病是指LVOTO,根据多普勒超声心动图测量静息或激发时LVOTG≥30 mmHg可诊断为肥厚型梗阻性心肌病。根据LVOTO变化情况,肥厚型梗阻性心肌病可分为静息梗阻性和隐匿梗阻性。前者指静息时存在LVOTG≥30 mmHg,后者指静息LVOTG<30 mmHg,激发后LVOTG≥30 mmHg[86]。
近来研究发现,右心室流出道也可出现梗阻情况,根据静息时右心室流出道压差≥25 mmHg诊断右室流出道梗阻[87]。
指静息状态及激发试验时左心室流出道均无压差出现(LVOTG<30 mmHg)。
这是临床最常用的分型方法,有利于指导治疗措施的选择。研究发现,静息梗阻性、隐匿梗阻性和非梗阻性三种类型各占1/3[86]。
这是临床最常见表型,其中1/3累及室间隔基底部,构成主动脉瓣下狭窄。舒张末期左心室间隔与后壁厚度之比≥1.3,称为非对称性室间隔肥厚。高血压伴下壁心肌梗死患者可以出现类似表现,此时要求左心室间隔与后壁厚度之比≥1.5[36]。
少数患者表现为左心室壁弥漫性(对称性)肥厚,难以与继发性心肌肥厚鉴别。
发病呈家族聚集,占60%~70%,多为常染色体显性遗传。
无家族性聚集的HCM患者称之为散发性HCM。
这种分型方法有利于指导遗传学研究和进行遗传咨询。
是HCM中相对少见的类型,在亚洲人群中发病率较高,日本和中国报道分别占HCM的15%~25%和11%~16%,而西方人群发病率较低为1%~7%,发病以男性为主,心电图的典型特征是巨大负相T波,其电压常>1.0 mV,可见于Ⅰ、aVL、V3~V6导联,伴相应导联R波增高及ST段压低,变化程度以V4导联最为显著,即V4≥V5≥V3或V6。诊断标准为超声心动图或CMRI检查显示舒张末期左心室心尖部室壁明显增厚(最大厚度≥15 mm),左心室心尖部与后壁最大厚度之比≥1.5,除外其他引起左心室肥厚的疾病。心尖肥厚型心肌病患者因无流出道梗阻,预后相对较好。
也是HCM中相对少见的类型,占HCM的3%~13%。特征改变是左心室中部乳头肌与室间隔中部心肌异常肥厚,伴有左心室心尖部与基底部心腔之间收缩末期压差。诊断标准:(1)显著的左心室中部室壁增厚,舒张末期最大室壁厚度≥15 mm(有明确家族史且室壁厚度≥13 mm)。(2)左心室中部峰值压差≥30 mmHg,常伴特征性收缩末期持续的异常高速血流(由心尖至心底部)及舒张早期二尖瓣反流,左心室中部收缩期梗阻或闭塞呈"沙漏形"或"哑铃状"。(3)除外其他可引起左心室肥厚的疾病。左心室中部肥厚型梗阻性心肌病患者常伴有明显且严重症状,合并心尖部室壁瘤和附壁血栓形成的比例较高,导致心力衰竭、卒中和SCD的发生,预后较差。
HCM的治疗目标包括缓解临床症状,改善心脏功能,延缓疾病进展,减少死亡。对于有症状且存在LVOTO患者,治疗目标是使用药物、外科室间隔切除术、酒精消融术或双腔起搏器治疗改善症状;对于有症状无LVOTO患者,治疗重点是管理心力衰竭、心律失常和心绞痛;对于药物治疗无效的进展性左心室收缩或舒张功能障碍患者,考虑心脏移植。对于无症状HCM患者,建议每年定期临床评估,无论是否存在LVOTO及程度,均不推荐室间隔消减治疗。所有HCM患者都应开展SCD风险评估和危险分层,进行相应的预防和治疗。
根据是否存在LVOTO,分为肥厚型梗阻性心肌病和肥厚型非梗阻性心肌病两类,两者治疗策略不同。
静息状态或激发试验LVOTG≥50 mmHg是采取侵入式治疗的阈值。LVOTG<50 mmHg时通常按照肥厚型非梗阻性心肌病的推荐意见进行管理。
1.一般治疗。
避免劳累、激动、突然用力,避免脱水,避免使用增强心肌收缩力和减轻心脏负荷的药物,如:洋地黄类、β受体激动剂、大剂量利尿剂、动脉及静脉血管扩张剂(硝酸酯类、5-型磷酸二酯酶抑制剂)(Ⅲ类,C级)。
应避免竞技性、暴发性的体育运动,刺激性的娱乐活动和高强度的体力活动(Ⅲ类,C级),可以考虑进行低强度的有氧运动(Ⅱa类,C级)[108]。
新发或控制欠佳的房颤会加重LVOTO引起的症状,应该考虑尽快转复窦性心律或适当控制心室率(Ⅱa类,C级)。
2.药物治疗。
1)β受体阻滞剂:可以使心肌收缩力减弱,减轻LVOTO,减少心肌耗氧,同时可以减慢心率,改善心室舒张期充盈,从而改善症状。应该作为改善症状一线治疗药物(Ⅰ类,B级),可选用美托洛尔、比索洛尔,从小剂量起始,逐渐增加至最大耐受剂量(患者能够耐受情况下静息心率达到55~60次/min)。普萘洛尔应用最早[109,110,111],疗效肯定,仍可应用,起始10 mg/次,每日3~4次,逐渐加量,最大可达每日200 mg。还可以应用阿替洛尔和索他洛尔[112]。不同β受体阻滞剂对肥厚型梗阻性心肌病患者的作用差异尚不明确。新生儿和儿童肥厚型梗阻性心肌病患者也可以考虑使用。
2)非二氢吡啶类钙离子通道阻断剂(CCB):具有负性肌力和频率作用,既可减轻LVOTO,又可改善心室舒张期充盈和局部心肌血流。其中,维拉帕米最为常用[113,114,115],对于β受体阻滞剂治疗有禁忌、不耐受或无效患者,建议应用维拉帕米(Ⅰ类,B级)(起始40 mg/次,3次/d,最大剂量每日480 mg)。对上述两类药治疗不耐受或存在禁忌患者,可考虑应用地尔硫 [116](Ⅱa类,C级)(起始60 mg/次,3次/d,最大剂量每日360 mg)。维拉帕米也可以用于儿童和青少年肥厚型梗阻性心肌病患者[117]。
[116](Ⅱa类,C级)(起始60 mg/次,3次/d,最大剂量每日360 mg)。维拉帕米也可以用于儿童和青少年肥厚型梗阻性心肌病患者[117]。
对于存在严重梗阻(LVOTG≥100 mmHg),或肺毛细血管楔压升高、全身血压降低的患者,应慎用维拉帕米[118],需要密切监测,避免引起血压降低导致LVOTG升高,诱发肺水肿。β受体阻滞剂与维拉帕米或地尔硫 合用需谨慎,可能会导致严重心动过缓及高度房室传导阻滞( atrioventricular block,AVB)。二氢吡啶类CCB(如硝苯地平)具有血管扩张作用,可能加重流出道梗阻,不推荐使用(Ⅲ类,C级)。
合用需谨慎,可能会导致严重心动过缓及高度房室传导阻滞( atrioventricular block,AVB)。二氢吡啶类CCB(如硝苯地平)具有血管扩张作用,可能加重流出道梗阻,不推荐使用(Ⅲ类,C级)。
3)丙吡胺:为Ⅰa类抗心律失常药物,有较强负性肌力作用,可抑制心肌收缩力,减慢射血速率,减轻SAM征象和二尖瓣反流,减少LVOTG,无致心律失常效应,也不增加SCD风险[119,120]。推荐丙吡胺与β受体阻滞剂或维拉帕米联合应用,并滴定至最大耐受剂量(通常每日400~600 mg)(Ⅰ类,B级)。也可考虑单独应用丙吡胺(Ⅱb类,C级)。丙吡胺治疗儿童肥厚型梗阻性心肌病没有证据,因此不推荐。
丙吡胺具有剂量依赖性的抗胆碱能效应,如:眼干、口干、排尿延迟、尿潴留、便秘等。会延长QT间期,在剂量上调过程中要注意校正QT间期,当校正QT间期>480 ms时要减少剂量。青光眼、有前列腺疾病,同时使用其他会延长QT间期药物(如胺碘酮和索他洛尔)患者,应避免使用丙吡胺。另外,伴房颤或容易发生房颤患者,也需谨慎使用,因为丙吡胺会增强房室传导,导致心室率加快。
4)小剂量襻利尿剂或噻嗪类利尿剂可考虑应用于有症状或伴液体潴留的肥厚型梗阻性心肌病患者以改善呼吸困难症状(Ⅱ b类,C级),但要避免低钾血症。
5)严重激发LVOTO患者可表现为低血压和肺水肿,要及时识别,给予口服或静脉β受体激动剂或血管收缩剂(苯肾上腺素、间羟胺和去甲肾上腺素)(Ⅱa类,C级)[6]。
无症状的肥厚型梗阻性心肌病患者,可以考虑应用β受体阻滞剂或维拉帕米,降低左心室压力(Ⅱb类,C级)。
3.侵入式治疗:侵入式治疗措施包括外科手术(室间隔切除术)、室间隔酒精消融术和双腔起搏器植入术,前两者统称室间隔消减治疗。
室间隔消减治疗的指征包括:(1)临床标准:患者存在严重呼吸困难或胸痛症状[纽约心脏协会(NYHA)心功能分级Ⅲ~Ⅳ级](Ⅰ类,B级)和(或)反复发作活动后晕厥,影响日常活动和生活质量(Ⅱa类,C级),充分药物治疗后效果不佳或者不能耐受药物的不良反应。(2)血流动力学标准:静息或激发LVOTG≥50 mmHg,与室间隔肥厚及二尖瓣SAM征象相关。(3)解剖标准:室间隔厚度足够进行安全有效的操作。室间隔消减治疗应在有HCM多学科管理专家团队及相关治疗经验的医疗中心进行,并且由有经验的医师实施手术(Ⅰ类,C级)。有经验的医师特指独立实施该手术超过20例,或在该手术超过50例的治疗中心工作并能独立实施该手术的医师。
无症状肥厚型梗阻性心肌病患者,无论梗阻程度如何,都不建议行室间隔消减治疗(Ⅲ类,C级)。
1)外科室间隔切除术[121,122,123,124,125,126]:(1)主要术式:开胸、经主动脉切口、室间隔肥厚心肌切除术,是治疗肥厚型梗阻性心肌病经典手术方法,始于20世纪60年代,称为经典Morrow手术。后经改良扩大了室间隔切除范围,远端超越二尖瓣叶室间隔接触部位,达到乳头肌基底部甚至心尖部,称为扩大室间隔心肌切除术或扩大(改良)Morrow手术。(2)手术指征:有室间隔消减治疗指征,能接受心脏外科手术的成人患者首选外科室间隔切除术(Ⅰ类,B级)。有室间隔消减治疗指征,合并需要外科手术疾病的患者(如:二尖瓣病变需要二尖瓣修复或置换、冠脉严重病变需冠脉旁路移植术),推荐外科室间隔切除术(Ⅰ类,C级)。有室间隔消减治疗指征,伴有并非单独由二尖瓣SAM征象引起的中重度二尖瓣反流,考虑行二尖瓣修复或置换术(Ⅱa类,C级)。若二尖瓣叶室间隔接触部位最大厚度≤16 mm,或单独室间隔切除术后仍有中重度二尖瓣反流,可以考虑行二尖瓣修复或置换术(Ⅱb类,C级)。(3)近期疗效:通过外科手术,使LVOTG显著降低,二尖瓣反流减轻或消除,左心房缩小,左心室压力改善,有效避免了心力衰竭的发生。(4)远期疗效:外科手术通过减轻流出道梗阻,可显著延长肥厚型梗阻性心肌病患者寿命。国外研究显示,肥厚型梗阻性心肌病患者外科室间隔切除术后1年、5年和10年生存率分别为98%、96%、83%,与普通人群之间无统计学差异,明显优于未接受外科手术患者(1年、5年和10年生存率分别为90%、79%、61%)[122]。近期我国一项研究显示,肥厚型梗阻性心肌病患者外科术后1年、5年累积生存率分别为99%和97%[125]。外科手术还可以显著减少肥厚型梗阻性心肌病患者SCD风险和植入ICD概率[126]。(5)并发症:有经验中心肥厚型梗阻性心肌病外科手术的死亡率<1%,外科室间隔切除术联合二尖瓣手术的死亡率为3%~4%。术后早期常见并发症:AVB(发生率3%~10%)、左束支传导阻滞、房颤(发生率20%~30%)、室间隔穿孔(发生率≤2%)、主动脉瓣关闭不全及残余梗阻或梗阻再发。
2)室间隔酒精消融术,又称经皮室间隔心肌消融术[127,128,129,130,131,132,133]:(1)机制:利用化学方法(96%~99%无水酒精)阻断梗阻部位冠脉,造成区域心肌坏死、消除室间隔肥厚,消除或减轻梗阻,从而改善症状和运动耐力,最早于1995年报道[127]。(2)适应证:参考2011年中华医学会心血管病分会室间隔心肌消融术治疗专题组专家共识[133],要求静息LVOTG≥50 mmHg或激发LVOTG≥70 mmHg,超声心动图检查符合肥厚型梗阻性心肌病诊断标准,梗阻位于室间隔基底段,MCE检查确定拟消融间隔支动脉支配肥厚梗阻的心肌,冠脉造影检查间隔支动脉适于行室间隔酒精消融术治疗。年老体弱、外科手术风险高或禁忌,不能接受心脏外科手术的患者,应考虑室间隔酒精消融术(Ⅱa类,B级)。不接受开胸手术患者,也可考虑室间隔酒精消融术作为候选方案(Ⅱb类,B级)。(3)近期疗效:术后室间隔厚度即刻减小,LVOTG降低,症状和心功能改善,活动耐力提高。LVOTG下降≥50%或LVOTG<30 mmHg是手术成功的标志。(4)远期疗效:室间隔酒精消融术可以长期(10年)改善患者症状和血流动力学,提高长期生成率。(5)并发症:围术期死亡率为1.0%~1.4%,远期死亡率约0.5%。围术期并发症主要包括:AVB(发生率7%~20%,10%~20%需植入心脏永久起搏器),右束支传导阻滞(第一间隔支动脉供血);冠脉损伤与非靶消融部位心肌梗死,以及心肌瘢痕诱导的室性心律失常。
3)双腔起搏器[134,135,136,137,138]:(1)机制:双腔起搏器治疗肥厚型梗阻性心肌病始于20世纪80年代,通过植入双腔起搏器(右心房-右心室顺序起搏),缩短房室间期,保证右心室起搏。右心室心尖部起搏改变了心脏除极顺序,使室间隔基底段除极延迟,同时左心室整体收缩性降低,从而使SAM征象减弱,LVOTO减轻,达到改善症状和心功能以及提高运动耐量的目的。(2)适应证:存在外科室间隔切除术或室间隔酒精消融术禁忌,或术后发生心脏传导阻滞风险高的窦性心律患者,可以考虑双腔起搏器治疗,以降低LVOTG或有利于β受体阻滞剂及维拉帕米等药物应用(Ⅱb类,C级)。如果有ICD适应证,可以考虑植入双腔ICD而不是单腔ICD(Ⅱb类,C级)。合并窦房结功能不全或AVB患者推荐双腔起搏器治疗(Ⅰ类,C级)。(3)疗效:一些小型研究显示,双腔起搏器治疗能降低LVOTG,改善患者的症状和生活质量,但结论不一致,其降低LVOTG效果不如室间隔酒精消融术[138]。
4)外科室间隔切除术与室间隔酒精消融术比较[139,140,141,142]:目前尚缺少两种治疗比较的随机对照研究,但多项荟萃分析结果显示,二者都是肥厚型梗阻性心肌病的有效治疗方式,在降低LVOTG,改善症状、活动耐量及病死率方面没有显著差别。因此临床实践中需要根据患者年龄、肥厚型梗阻性心肌病形态学特点、伴随疾病及患者意愿等方面因素综合评估后做出个体化选择。(1)年龄方面,成人肥厚型梗阻性心肌病患者只要耐受心脏外科手术,一般首选外科室间隔切除术(Ⅰ类,B级),除非患者高龄、因各种原因不能耐受外科治疗,室间隔酒精消融术作为可选择治疗方式(Ⅱa类,B级)。对于未成年患者,由于病情发展快、室间隔肥厚严重、SCD风险高,一般建议行外科室间隔切除术(Ⅱa类,C级)[143];室间隔酒精消融术在儿童和青少年中尚有争议,年龄<21岁者不推荐室间隔酒精消融术(Ⅲ类,C级)。(2)肥厚型梗阻性心肌病形态学方面:室间隔酒精消融术效果最佳的为室间隔基底段局部肥厚,部分左心室中部肥厚型梗阻性心肌病患者,如果有合适的间隔支动脉,也可以考虑采用。对于室间隔显著增厚(≥30 mm)患者疗效不肯定,通常不考虑(Ⅱb类,C级),建议外科室间隔切除术。对于轻度肥厚(≤16 mm)患者,二种手术发生室间隔穿孔的风险都较高,考虑单纯二尖瓣修复或置换术,或双腔起搏器治疗(Ⅱb类,C级)。(3)伴随疾病:对合并其他需要外科治疗疾病(如冠脉三支病变需冠脉旁路移植术)患者,首选外科室间隔切除术。若合并冠脉单支病变(前降支),可先行室间隔酒精消融术再行冠脉介入治疗。另外,外科术后左束支传导阻滞发生率高,若患者术前已存在右束支传导阻滞,术后易出现三度AVB,需植入永久心脏起搏器,所以外科治疗要慎重。相反,室间隔酒精消融术后右束支传导阻滞发生率高,若患者术前已存在左束支传导阻滞,则需慎重选择室间隔酒精消融术。
5)三种侵入式治疗措施的比较:外科室间隔切除术于20世纪60年代开始应用于肥厚型梗阻性心肌病的治疗,至今已有50余年历史,降低LVOTG、改善症状、延长寿命的疗效明确,是符合手术指征并且能耐受心脏外科手术患者的首选治疗方式(Ⅰ类推荐)。室间隔酒精消融术于20世纪90年代应用于肥厚型梗阻性心肌病治疗,至今有近20年历史,在降低LVOTG、改善症状及预后方面与外科室间隔切除术相当,可作为不能手术或不愿手术患者的一种替代治疗方式(Ⅱa类推荐)。双腔起搏器治疗肥厚型梗阻性心肌病始于20世纪80年代末,疗效不如前两者,目前主要用于因各种原因不能行外科室间隔切除术和室间隔酒精消融术患者(Ⅱb类),尤其是合并其他起搏器适应证时。
左心室中部肥厚型梗阻性心肌病患者往往临床症状更重,更易出现SCD、心力衰竭和心尖部室壁瘤形成(约20%~25%),常伴有附壁血栓形成,卒中风险高,预后更差。
患者需要使用大剂量β受体阻滞剂、维拉帕米或地尔硫 等药物治疗,但效果欠佳。单中心小型研究结果显示,经主动脉或心尖切口心肌切除术可缓解心室中部梗阻,短期效果较好,但长期预后尚缺乏证据。
等药物治疗,但效果欠佳。单中心小型研究结果显示,经主动脉或心尖切口心肌切除术可缓解心室中部梗阻,短期效果较好,但长期预后尚缺乏证据。
单纯心尖室壁瘤无须特殊处理。对于室壁瘤瘢痕处产生单形性室性心动过速患者可以考虑行射频消融术。当心尖室壁瘤合并附壁血栓时,需要长期口服抗凝治疗。心尖部室壁瘤形成可能会增加某些患者SCD风险,但如果不存在其他增加SCD风险的临床特征,不推荐预防性植入ICD。
HCM患者常有胸闷、气短等呼吸困难症状,主要由左心室舒张功能异常引起,表现为LVEF保留(LVEF≥50%)的心力衰竭(heart failure wtih preserved ejection fraction,HFpEF)。部分表现为LVEF降低(LVEF<40%)的心力衰竭(heart failure with reduced ejection fraction,HFrEF)。治疗措施如下:
(1)合并症状性HFpEF(NYHA心功能Ⅱ~Ⅳ级)患者,药物治疗目标是控制心率以降低左心室舒张末压,改善左心室充盈。应考虑应用β受体阻滞剂和非二氢吡啶类CCB(维拉帕米或地尔硫 )(Ⅱa类,C级),也可谨慎使用小剂量襻利尿剂或噻嗪类利尿剂(Ⅱa类,C级)。若合并房颤,应转复窦性心律或控制心室率,不推荐使用地高辛。(2)合并症状性HFrEF(NYHA心功能Ⅱ~Ⅳ级)患者,应该按照最新心力衰竭指南的建议,使用肾素血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)、β受体阻滞剂、醛固酮受体拮抗剂和襻利尿剂(Ⅱa类,C级)。若合并房颤,可单独应用地高辛(0.125~0.250 mg/d)或与β受体阻滞剂联合应用控制心室率(Ⅱb类,C级)。
)(Ⅱa类,C级),也可谨慎使用小剂量襻利尿剂或噻嗪类利尿剂(Ⅱa类,C级)。若合并房颤,应转复窦性心律或控制心室率,不推荐使用地高辛。(2)合并症状性HFrEF(NYHA心功能Ⅱ~Ⅳ级)患者,应该按照最新心力衰竭指南的建议,使用肾素血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)、β受体阻滞剂、醛固酮受体拮抗剂和襻利尿剂(Ⅱa类,C级)。若合并房颤,可单独应用地高辛(0.125~0.250 mg/d)或与β受体阻滞剂联合应用控制心室率(Ⅱb类,C级)。
药物治疗难以控制的症状性HFrEF(NYHA心功能Ⅱ~Ⅳ级)伴有左束支传导阻滞且QRS间期>130 ms患者,可考虑应用CRT(Ⅱ b类,C级)。对已进展至严重左心室收缩功能障碍(LVEF≤35%)患者,应该按照相关指南决定是否行CRT。
药物治疗难以控制的中重度症状性HFrEF(NYHA心功能分级Ⅲ~Ⅳ级)或难治性室性心律失常患者,应该考虑原位心脏移植(Ⅱa类,B级)。对于药物治疗难以控制的中重度症状性HFpEF,也可以考虑原位心脏移植(Ⅱb类,B级)。
HCM终末期心力衰竭患者由于左心室腔缩小及左心室舒张受限,左心室辅助装置的植入较为困难,临床使用较少。有研究显示,连续轴流左心室辅助装置可能使HCM终末期心力衰竭患者获益,可以考虑用于药物和器械治疗无效、适合心脏移植患者移植前的过渡治疗,以改善症状、减少等待移植期间由于心力衰竭恶化导致的住院和提前死亡(Ⅱ b类,C级)。
房颤是HCM患者最常见的心律失常,最新荟萃分析结果显示,HCM患者中房颤的患病率和年发生率分别为22.5%和3.1%,房颤患者中卒中和周围栓塞的患病率和年发生率分别为27.1%和3.8%[155]。研究发现,年龄和左心房增大是HCM患者发生房颤的最主要危险因素。左心房内径是HCM患者发生房颤和卒中的共同预测因素。因此,对于窦性心律、左心房内径≥45 mm的患者,考虑每隔6~12个月行48 h Holter检查检测有无房颤(Ⅱa类,C级)。心房扑动的血栓栓塞危险与房颤相似,处理也相同。
新发房颤会导致或加重心力衰竭,应根据最新房颤指南建议紧急处理[153,154]。(1)恢复窦性心律:血流动力学不稳定的患者,建议给予紧急直流电复律(Ⅱ a类,C级),直流电转复后应用胺碘酮维持窦性心律(Ⅱ a类,B级)。伴有严重心绞痛或心力衰竭症状,建议静脉应用β受体阻滞剂和胺碘酮。(2)降低心室率:血流动力学稳定患者,推荐口服β受体阻滞剂和非二氢吡啶类CCB控制心室率(Ⅰ类,C级)。房颤伴预激综合征患者禁用非二氢吡啶类CCB以及腺苷;LVEF正常HCM患者应避免使用地高辛;也应避免使用Ⅰc类抗心律失常药物(氟卡尼及普罗帕酮),后者可能会延长QRS时限和QT间期,还会使房颤转为心房扑动和1∶1房室传导,导致心室率加快。
心室率控制并且口服维生素K拮抗剂华法林抗凝达标(国际标准化比值为2.0~3.0)至少3周后考虑行直流电转复以恢复窦性心律。若抗凝不足3周,建议行TEE检查以排除左心房(心耳)血栓形成。
HCM患者并未纳入房颤血栓栓塞预防临床试验中,因此不推荐HCM伴房颤患者应用CHA2DS2-VASC评分系统来计算卒中风险。但由于此类患者发生卒中的风险高,建议所有HCM伴阵发性、持续性或永久性房颤患者口服华法林抗凝治疗,除非存在禁忌证(Ⅰ类,B级)。心房扑动患者也推荐口服抗凝治疗(Ⅰ类,C级)。开始口服抗凝治疗前,应根据HAS-BLED评分系统评估患者出血风险(Ⅱa类,B级),对评分≥3分的出血高危患者(不是抗凝禁忌),应提高警惕,加强临床监测。
调整华法林剂量后仍不达标(未坚持服药、药物不良反应或不能监测国际标准化比值)患者,建议改用新型口服抗凝药,包括直接凝血酶抑制剂(达比加群酯)和口服Ⅹa因子抑制剂(如利伐沙班、阿哌沙班)(Ⅰ类,B级)。除非存在可逆房颤病因,建议患者终身口服华法林(国际标准化比值2.0~3.0)抗凝,即使已经转复窦性心律(Ⅰ类,C级)。
建议单独或者联合使用β受体阻滞剂和非二氢吡啶类CCB控制阵发性、持续性、永久性房颤患者的心室率(Ⅰ类,C级)。药物剂量调整目标是使静息心室率<100次/min,同时避免出现症状性心动过缓。对于LVEF<40%患者,可以考虑单独应用地高辛(0.125~0.250 mg/d)或与β受体阻滞剂联合控制心室率(Ⅱb类,C级)。
若药物治疗难以控制心室率,或不能预防房颤发生,或出现不能耐受的药物不良反应,可以考虑行房室结消融术来控制心室率(Ⅱb类,C级)。消融术后LVEF≥50%的阵发性房颤患者,推荐植入带模式转化功能的双腔起搏器;持续性或永久性房颤患者,推荐植入带频率应答功能的单腔起搏器(Ⅰ类,C级)。消融术后LVEF<40%的房颤患者,考虑植入CRT(Ⅱb类,C级)。
房颤节律控制方式(转复窦性心律并维持窦性心律)主要包括抗心律失常药和射频消融术两种,目前无两者远期疗效评估的随机对照试验。(1)药物治疗:胺碘酮对于维持窦性心律、减少血栓栓塞事件、减少直流电复律有效。但胺碘酮、β受体阻滞剂和非二氢吡啶类CCB三者对于维持窦性心律及首次房颤发作后的生存率方面没有显著差别。决奈达龙可能增加心血管事件,不推荐用于HCM伴房颤患者。(2)射频消融术:药物难以控制症状或不能口服抗凝药物,且左心房没有明显增大患者,可以考虑射频消融术(Ⅱa类,B级)。HCM伴症状性房颤患者在行外科室间隔切除术时也可考虑外科迷宫手术治疗(Ⅱb类,C级)。
HCM患者常伴活动后胸痛症状,类似劳力性心绞痛表现,需要与心外膜冠脉粥样硬化狭窄性病变(直径狭窄≥50%)引起的心肌缺血(冠心病)相鉴别,部分HCM患者可同时合并冠心病。
心电图、运动平板试验和核素心肌灌注显像只能显示心肌缺血,不能明确是否合并冠心病。冠脉造影检查是明确患者是否合并冠心病的金标准,但冠脉增强CT检查也有良好的诊断价值。
采用冠脉造影检查,国内外报道的发生率约为19%~27%。HCM合并冠心病增加了患者发生不良事件的风险,其年死亡率约为10%,明显高于未合并冠心病的HCM患者(约1%)。
冠脉造影检查结果发现,HCM患者中冠脉肌桥的发生率明显增高(15%~30%),高于普通人群冠脉造影中肌桥的发生率(1%~3%)。肌桥与HCM患者预后的关系尚不明确。
需要根据患者HCM类型、冠脉病变特点及合并症等综合因素制定相对个体化的治疗方案。
国外研究资料显示,SCD是HCM患者的首位死因,也是HCM最严重的并发症,年均发生率大约为0.5%~1.5%。其最常见的病理生理机制是致命性室性心律失常,包括自发性心室颤动和持续性室性心动过速。但国内观察SCD发生率远低于国外,尤其长期应用较大剂量β受体阻滞剂患者。
HCM患者SCD的风险评估需综合多种临床因素(表1)。通常认为,具有至少1项明确的危险因素患者具有较高的SCD风险(高危),而不具有上述危险因素的患者发生SCD的风险较低(低危)。

成人HCM患者SCD风险增高相关的主要临床因素
成人HCM患者SCD风险增高相关的主要临床因素
| 危险因素 | 说明 | |
|---|---|---|
| 明确的危险因素 | ||
| 年轻时发生SCD的家族史 | ≥1个一级亲属(无论是否诊断HCM)40岁以前或确诊HCM的一级亲属在任何年龄发生SCD | |
| 难以解释的晕厥 | 经过检查不能解释的非神经心源性晕厥,尤其近6个月内发生的晕厥,预测SCD的价值更大 | |
| 严重左心室肥厚 | 左心室最大室壁厚度≥30 mm与SCD风险增高相关 | |
| 自发的非持续性室性心动过速 | 定义为≥3个连续性室性期前收缩,心率≥120次/min(<200次/min)、持续时间<30 s(Holter检查) | |
| 运动血压反应异常 | 定义为运动时收缩压上升<20 mmHg或收缩压下降>20 mmHg,主要适用于年龄≤40岁患者 | |
| 潜在的危险因素 | ||
| 左心室流出道梗阻 | 静息或Valsalva动作期间最大LVOTG≥30 mmHg。降低LVOTG治疗对SCD风险的影响不确定 | |
| CMRI-LGE阳性 | 反映心肌纤维化或瘢痕,与Holter检查发现自发的非持续性室性心动过速相关,可能与SCD相关 | |
| 心尖部室壁瘤 | 纤维化的室壁瘤和交界处的瘢痕容易引发致命性心律失常,导致SCD | |
| 终末期HCM | 大量纤维化导致不可逆的左心室收缩功能障碍和难治性心力衰竭,常合并致命性心律失常,导致SCD | |
注:HCM:肥厚型心肌病,SCD:心脏性猝死,CMRI:心脏磁共振成像,LGE:钆对比剂延迟强化,LVOTG:左心室流出道峰值压差
上述主要临床因素只能反映SCD的相对风险而不是绝对风险,只能在一定程度上区分高危和低危患者。新近一项研究开发了一种新的风险预测模型(HCM Risk-SCD),可以较准确地预测HCM患者5年发生SCD的绝对风险。公式为:HCM患者5年SCD发生概率=1-0.998exp(预测指数)。预测指数=[0.15939858×最大室壁厚度(mm)]-[0.00294271×最大室壁厚度2(mm2)]+[0.0259082×左心房内径(mm)]+[0.00446131×静息/Valsalva动作期间最大LVOTG(mmHg)]+[0.4583082×SCD家族史]+[0.82639195×NSVT]+[0.71650361×难以解释的晕厥]-[0.01799934×临床评估时年龄(岁)]。
根据该预测模型计算的5年SCD发生概率高低,将HCM患者分为高危(5年SCD发生概率≥6%)、中危(5年SCD发生概率≥4%但<6%)和低危(5年SCD发生概率<4%)。
该预测模型只适用于年龄≥16岁,既往无持续性室性心动过速或自发性心室颤动导致心脏骤停复苏病史及自发性持续性室性心动过速导致晕厥或血流动力学紊乱病史的成年HCM患者(Ⅰ类,B级)。由于左心室最大室壁厚度与SCD的关系为非线性,当左心室最大室壁厚度≥35 mm时,该公式计算的SCD风险可能会低估,需谨慎使用该公式。建议HCM患者首次评估时利用该公式计算5年SCD发生概率,以后每隔1~2年或者临床状况发生变化时再次评估(Ⅰ类,B级)。
该模型来自欧洲一项回顾性纵向队列研究结果,在其他国家和地区的适用性需要进行评估。近期在包含南美、北美、中东及亚洲国家人群的模型验证中显示该模型具有良好的预测能力[173,174]。国内一项研究显示,相对于2011年美国心脏协会的HCM指南中的SCD危险分层模型,该模型适用性较好,但估测的SCD事件率可能低于实际事件率[175]。
(1)限制运动:HCM患者,尤其存在SCD主要危险因素和(或)LVOTO的患者,建议避免竞技性运动和高强度体力活动(Ⅰ类,C级)[108]。(2)抗心律失常药物:目前尚无随机对照试验证实抗心律失常药可以预防HCM患者发生SCD,包括胺碘酮、丙吡胺[176]。(3)外科室间隔切除术:有研究显示,外科室间隔切除术可以显著降低肥厚型梗阻性心肌病患者的SCD风险[126]。(4)ICD:是目前预防SCD最有效的方式。
二级预防:对于由于持续性室性心动过速或自发性心室颤动导致心脏骤停患者,或者有自发性持续性室性心动过速导致晕厥或血流动力学紊乱的患者,如果预期寿命>1年,建议植入ICD进行二级预防(Ⅰ类,B级)。
一级预防:对于既往无持续性室性心动过速或自发性心室颤动导致心脏骤停,或自发性持续性室性心动过速导致晕厥或血流动力学紊乱病史的HCM患者,建议依据是否存在上述明确的危险因素或依据HCM Risk-SCD模型计算5年SCD发生概率(图2),评估SCD发生风险,决定是否植入ICD进行一级预防。
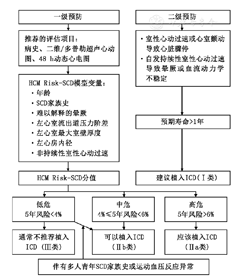

注:HCM:肥厚型心肌病,SCD:心脏性猝死,ICD:植入式心脏转复除颤起搏器
ICD植入相关的治疗并发症(包括围术期和长期随访期间,发生率约为每年4%)和植入后的不适当放电(发生率约为25%)是ICD一级预防前需要考虑的问题。因此,建议患者植入ICD进行一级预防前要进行详细的临床评估和咨询,充分考虑到并发症的可能性并评估风险获益比(Ⅰ类,C级)。
ICD装置选择:具有ICD适应证、不需要房室起搏的年轻患者、伴有持续性或永久性房颤患者,考虑植入单腔ICD;具有ICD适应证、有房室起搏指征的老年患者(年龄>65岁),伴有阵发性房颤患者,考虑植入双腔ICD(Ⅱa类,C级),静息或激发时LVOTOG≥50 mmHg的肥厚型梗阻性心肌病患者,可以考虑植入双腔ICD(Ⅱb类,C级)。此外,ICD可以经静脉、心外膜和皮下植入。患者如果无起搏适应证,或者经静脉植入ICD失败或禁忌,可以考虑植入皮下ICD(S-ICDTM)(Ⅱb类,C级)。
ICD术后优化:ICD植入后应优化药物治疗和起搏器程控,若仍有症状性室性心律失常或反复放电,建议给予β受体阻滞剂和(或)胺碘酮治疗(Ⅰ类,C级)。ICD植入后如果由于规律的室上性心动过速导致不恰当放电,建议电生理检查以明确并治疗任何可消融的心律失常(Ⅰ类,C级)。
(1)风险评估:SCD家族史、难以解释的晕厥、严重左心室肥厚(左心室最大室壁厚度≥30 mm或Z值≥6)、非持续性室性心动过速是儿童发生SCD的主要危险因素。(2)防治措施:对于发生致命性室性心律失常或心脏骤停的儿童,建议经静脉(或心外膜)植入ICD进行二级预防(Ⅰ类,B级)。一级预防:具有两个或以上危险因素的儿童患者,给予恰当咨询和充分评估后应该考虑植入ICD进行一级预防(Ⅱa类,C级),通常植入单腔ICD即可满足需求又可减少并发症。仅有一个危险因素的儿童患者,在仔细权衡ICD植入对于患者及其家庭的利弊后也可以考虑植入(Ⅱb类,C级)。
非持续性室性心动过速在HCM患者Holter监测中常见,与年龄增加、左心室壁厚度及CMRI-LGE相关。非持续性室性心动过速是SCD的危险因素,但大多数并不需要抗心律失常治疗。
持续性室性心动过速(持续时间≥30 s)在普通HCM患者中不常见,但在合并心尖部室壁瘤患者中比较常见。对血流动力学不稳定的持续性室性心动过速患者,应该考虑植入ICD并使用β受体阻滞剂或胺碘酮控制室性心动过速发作。对局灶起源的持续性室性心动过速患者可以考虑行电生理检查及射频消融治疗。
HCM患者治疗流程图见图3。
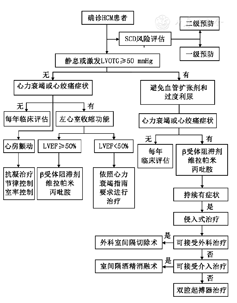

注:HCM:肥厚型心肌病,SCD:心脏性猝死;LVOTG:瞬时峰值压差,LVEF:左心室射血分数
妊娠会引起血浆容量和心输出量增加、全身血管阻力降低和高凝状态,使得患HCM的母亲及胎儿的风险增加,尤其是合并LVOTO和左心室舒张功能异常患者,对容量负荷的耐受性较差。因此,HCM女性患者在孕前应进行充分及时的风险评估和咨询(Ⅰ类,C级)。
建议对HCM育龄女性患者进行有关安全有效避孕措施的咨询(Ⅰ类,C级)。避孕措施包括屏障避孕(安全套、膈膜、盆腔环)、口服避孕药和宫内避孕器等。一般口服低剂量避孕药(20~30 μg乙炔雌二醇)可以安全有效用于多数HCM妇女,但血栓栓塞风险增高患者(伴有心力衰竭或房颤的妇女),应保证充分口服抗凝药物治疗。
多数HCM女性能够很好地耐受妊娠,除非为高危产妇。孕前有症状、左心室收缩功能受损或存在心律失常的患者,孕期容易出现并发症。孕期LVOTG可以轻微升高,与孕期并发症增多相关。
应在孕前行超声心动图检查评估HCM女性的心室功能、二尖瓣反流及LVOTO情况。孕前可以采用运动负荷试验(80%预计最大心率)来评估患者的心脏储备功能、心率反应性和心律失常。根据世界卫生组织(WHO)改良母体心血管风险分类法,HCM女性分为Ⅰ~Ⅳ级,根据不同分级进行针对性的孕期管理。
产前遗传诊断指在妊娠初期利用绒毛膜标本或羊膜腔穿刺标本进行基因检测,有助于早期发现胎儿是否携带致病基因,但是该方法除在检测时机、准确性、安全性诸多方面仍存在问题外,如何处理基因型阳性携带者还存在医学伦理问题,并非所有致病基因携带者在其一生中均会出现临床表型。其他措施如:收养、人工授精、使用捐赠的配子以及胚胎植入前遗传学诊断等有助于优生优育。此外,也不推荐利用胎儿超声心动图检测HCM,因为胎儿心脏表达的概率很低,除非存在代谢性疾病。
(1)孕期监测和评估:根据WHO分类不同,孕期每1~3个月评估1次,应在有多学科专家团队的中心进行。评估重点包括症状、LVOTO、心律失常和心室功能。孕期每3个月或出现新症状时应行超声心动图检查。(2)孕期药物治疗:孕期处方药物治疗时应考虑到对胎儿可能产生的有害效应,但最终应以母亲的利益为准。①β受体阻滞剂:孕前已经使用β受体阻滞剂,孕期继续使用(Ⅱa类,C级)。孕前未使用β受体阻滞剂,如果孕期出现新症状,应开始使用β受体阻滞剂(Ⅰ类,C级)。其中,美托洛尔使用最广泛,不建议使用阿替洛尔,因其与胎儿生长迟缓发生率增加相关。孕期使用β受体阻滞剂,建议监测胎儿生长和新生儿状况(Ⅰ类,C级)。②非二氢吡啶类CCB:只有在权衡获益大于风险时才可使用。③丙吡胺:可能诱导宫缩和分娩,孕期尽量避免使用。④胺碘酮:有导致胎儿甲状腺毒性、生长发育迟缓和心动过缓的风险及神经系统不良反应,尽量避免使用。⑤抗凝治疗:合并房颤患者,可在妊娠早期(前3个月)和36周以后使用低分子肝素抗凝(需监测Ⅹa因子),或在妊娠中晚期使用华法林抗凝治疗(Ⅰ类,C级)。不建议使用新型口服抗凝药。(3)孕期非药物治疗:孕期如果对房颤耐受性差,可以考虑在妊娠期间进行复律(Ⅱa类,C级),但应在严密心脏监测下进行,或者实施紧急剖宫产。如果有指征,可以在孕期行起搏器或ICD植入,最好在超声指导下进行。
多数患者可以首选经阴道自然分娩(Ⅰ类,C级)。具有产科指征,或者有严重LVOTO、严重心力衰竭、口服抗凝药期间时出现早产的女性需要考虑剖宫产。硬膜外麻醉和椎管内麻醉有利于减少患者痛苦和压力,但需要谨慎使用,避免血管扩张和低血压,特别是当存在严重LVOTO时。心律失常风险高危患者,分娩过程中应严密监控心率和节律。为避免低血压和心动过速,催产素只能缓慢输注。分娩后应临床观察24~48 h,警惕出现产后肺水肿。
HCM患者通常需要终生随访,监测症状、不良事件风险、LVOTO、左心室功能和心脏节律的变化。疾病的严重程度、年龄和症状决定了监测频率。
临床状况稳定患者,建议每隔12~24个月进行一次12导联心电图和超声心动图的临床评估(Ⅰ类,C级)。任何时候患者症状发生变化时建议进行一次12导联心电图和超声心动图的临床评估(Ⅰ类,C级)。
临床状况稳定患者,建议每隔12~24个月,或左心房内径≥45 mm的窦性心律患者,建议每隔6~12个月,进行一次24~48 h Holter检查,评估无症状性房性和室性心律失常(Ⅰ类,C级)。患者主诉心悸或发生晕厥时,也建议行24~48 h Holter检查(Ⅰ类,C级)。
临床状况稳定患者每隔2~3年,或症状进展患者每隔1年,应考虑行运动负荷试验(Ⅱa类,C级),也可考虑进行心肺运动试验(Ⅱb类,C级),有利于提供疾病恶化的客观证据。
临床状况稳定患者每隔5年,或者症状进展患者每隔2~3年,可以考虑进行CMRI检查评估(Ⅱb类,C级)。
进行室间隔消减治疗的患者,术后完整的评估包括术后1~3个月及6~12个月时进行心电图、超声心动图和Holter监测。
HCM是一种高度异质性的心脏疾病,从婴儿到老人的所有年龄段均可能发病,有多种不同的基因型(遗传异质性)和临床表现(表型异质性),自然病程不尽相同,预后差别很大。大多数个体可能日常生活无明显障碍,不需要手术或介入治疗,寿命与正常人无区别;而另一部分患者出现明显临床表现,甚至严重并发症,导致病情恶化或死亡。
目前文献报道成人HCM患者年死亡率约为1%~2%。主要死因包括SCD、进展性心力衰竭及HCM相关的房颤导致的卒中。其中,年轻人死因主要是SCD,而老年人死因主要是HCM相关的卒中和心力衰竭。
但是,目前有多种治疗方式可以改变HCM患者的自然病程。例如:药物、外科室间隔切除术或室间隔酒精消融术可以减轻LVOTO,规范药物治疗可以控制心力衰竭发作,药物、射频消融术或外科迷宫手术可以治疗房颤,植入ICD可以有效预防SCD的发生,终末期HCM还可以进行心脏移植。
撰写组成员(按姓氏笔画排序):
王 江 王 昆 王水云 王志民 尤世杰 白 玲
许顶立 肖俊杰 余 静 张 健 张宇辉 罗素新
周 洲 段福建 顼志敏 高传玉 郭小梅 唐其柱
黄晓红 董念国 董建增 樊朝美
专家组成员(按姓氏笔画排序):
于 波 马长生 马爱群 王 江 王 昆 王水云
王志民 尤世杰 白 玲 朱文玲 许顶立 李小鹰
李占全 李虹伟 李培峰 宋云虎 杨艳敏 杨新春
肖俊杰 余 静 张 钲 张 健 张宇辉 张抒扬
陈义汉 罗素新 周 洲 段福建 顼志敏 高传玉
郭小梅 唐其柱 黄 洁 黄 峻 黄晓红 董吁钢
董念国 董建增 樊朝美
学术秘书:
张宇辉 邹长虹 张荣成 郭曦滢

























