
利用基于体素形态学测量(voxel-based morphometry,VBM)及基于表面形态学测量方法,探讨伴发腭裂言语障碍(cleft palate speech disorder,CPSD)的唇裂合并腭裂(clefts lip with palate,CLP)儿童的脑灰质结构形态学变化,为深入探索CLP人群腭裂言语障碍的神经机制提供参考。
选取2017年1月至2022年1月就诊于首都医科大学口腔医学院口腔颌面整形创伤外科,伴发CPSD的CLP患儿29例(CLP组),其中男性9例,女性20例,年龄(9.6±3.2)岁(5~17岁)。同期于首都医科大学附属北京儿童医院招募健康儿童33名(健康对照组),其中男性9名,女性24名,年龄(9.6±2.4)岁(5~16岁)。两组受试者均行MRI三维T1结构像序列扫描,并利用统计参数图软件SPM12软件中VBM和CAT12工具箱进行全脑灰质体积、皮质厚度、折叠系数等分析。采用双样本t检验对两组进行全脑灰质形态学分析,团块水平采用族错误率(family-wise error rate,FWER)校正进行多重比较校正,以双侧P<0.05 为差异有统计学意义。
健康对照组的年龄和性别与CLP组的差异均无统计学意义(t=-0.07,P=0.944;χ2=0.11,P=0.745)。与健康对照组相比,CLP组左侧颞下回、右顶下缘角回、左小脑上部灰质体积显著减小(P<0.05),右内侧额上回体积显著增加(P<0.05);与健康对照组相比,CLP组受试者的左侧额下回岛叶部以及右侧脑岛部皮质厚度显著变薄(FWER校正,P=0.035);与健康对照组相比,CLP组右侧半球扣带回峡部折叠系数显著增大(FWER校正,P=0.040)。
与健康对照组相比,伴发CPSD的CLP儿童存在多个语言相关脑区灰质体积减小、皮质厚度减小、折叠系数增大,这些与语言相关的脑区灰质形态学异常改变可能与CLP人群特有的腭裂言语障碍相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
唇裂伴腭裂(clefts lip and palate,CLP)是最常见的先天性口腔颌面部畸形之一[1],在我国新生儿中的发生率为1/500[2],中国拥有世界上最多数量的CLP人群。很多CLP儿童或成人常伴发腭裂言语障碍(cleft palate speech disorder,CPSD)[3],过去认为CPSD的成因主要与腭部裂隙及手术时间过晚相关[4, 5]。随着MRI技术在语言及言语病理机制研究中的广泛应用,近年有学者提出,与言语及语言功能相关的脑区结构异常可能是造成CLP患者言语问题的基础[6, 7]。谢娜等[6]对10例CLP婴幼儿受试者(平均年龄14.4个月)及10名健康婴幼儿进行灰白质密度和体积的对比研究,结果显示CLP婴儿多个认知相关脑区结构异常,该研究推测CLP患者伴发的言语、听觉及社会适应行为异常,可能是中枢神经系统结构异常和功能紊乱导致。Li等[8]研究发现,伴发CPSD的CLP成年患者在额叶、颞叶和顶叶表现出改变的指标,这些形态变化是CLP成人语言相关脑区结构的特征。目前,研究仅针对CLP成人患者CPSD的脑机制进行初步探讨[6,8],尚少见针对CLP儿童CPSD的脑机制研究报道。从方法上来说,既往研究的实验设计较简单,仅对比了脑结构的灰质体积,不能全面考察CPSD人群的语言相关功能及结构变化;从研究对象分类上看,成年人群和儿童人群的语言及言语习得策略不同。因此,本研究对处于语言发育关键期的5~12岁CLP儿童人群进行CPSD脑机制的研究,以深入了解其病理生理机制,为CPSD 的早期识别和早期干预提供科学依据。
MRI技术及基于体素形态学测量(voxel-based morphometry,VBM)、基于表面形态学测量(surface-based morphometric,SBM)的图像处理分析技术[9, 10],为CPSD人群的大脑形态学研究提供了可行、可靠的技术支持。本研究以伴发CPSD的CLP儿童人群和健康儿童为研究对象,应用MRI技术,基于VBM、SBM分析方法,探讨伴发CPSD的CLP儿童脑灰质的结构形态学变化,以期为深入探索CLP儿童CPSD产生的神经机制及其深层次原因、CPSD早期识别和早期干预提供参考。
本项研究为横断面研究,研究已获得首都医科大学附属北京口腔医院伦理委员会批准(批准号:CMUSH-IRB-KJ-PJ-2019-04)。本研究在实施过程中严格遵守相关医学伦理和研究知情同意等问题的有关规定和要求。所有入组受试者,均由具有5年以上相关工作经验的临床医师进行体格检查及量表评估,MRI扫描操作由经过实验操作培训且工作时长3年以上的核磁扫描技术人员完成。
1. 研究对象及分组:本研究以伴发CPSD的CLP儿童人群和健康儿童为研究对象。
(1)CLP组:选取2017年1月至2022年1月于首都医科大学口腔医学院口腔颌面整形创伤外科就诊的29例伴发CPSD的CLP儿童患者,其中男性9例,女性20例,均为汉族,年龄为(9.6±3.2)岁(5~17岁)。
纳入标准:①CLP患儿均在出生后8~12个月时行腭裂手术,腭咽闭合良好;②听力正常(双耳纯音测听≤30 dB,A型曲线);③智力正常,韦氏智力测试智商(intelligence quotient,IQ)≥90分;④右利手;⑤ 有2种以上CPSD典型特征,如辅音弱化、压力性辅音缺失、声门塞音、喉塞音、腭化音、侧化音;⑥ 汉语语音清晰度字表得分≤50分;⑦未曾接受语音康复训练;⑧裸眼视力1.0及以上或矫正视力1.0及以上,生长及教育环境无特殊;⑨无MRI检查禁忌证,无药物滥用史及神经病遗传或既往史。
排除标准:①神经系统的疾病或其他精神类疾病遗传史或既往史;②在入组前1年内接受过系统的药物及心理治疗;③无法配合相关评估检查者;④拒绝参加本研究者。
(2)健康对照组:2017年1月至2022年1月通过首都医科大学附属北京儿童医院宣传广告招募受试者,共招募健康儿童33名,其中男性9名,女性24名,年龄(9.6±2.4)岁(5~16岁)。
纳入标准:①听力正常(双耳纯音测听≤30 dB,A型曲线);②智力正常,韦氏智力测试IQ≥90分;③汉语语音清晰度字表得分>96分;④右利手;⑤裸眼视力1.0及以上或矫正视力1.0及以上;⑥生长及教育环境无特殊;⑦无药物滥用史及神经病遗传或既往史;⑧无MRI检查禁忌。
排除标准:同CLP组。
2. 数据采集:所有受试者在首都医科大学附属北京儿童医院放射科使用3.0 T磁共振成像系统(GE,Medical systems Discovery MR750,美国)和8通道头线圈进行扫描,获得高分辨率的三维T1加权结构像数据。所有受试者均由同一位具有5年MRI数据采集经验的医学影像专业主管技师按同一扫描条件完成。扫描开始前,所有受试者均戴用专用防噪音耳塞,以尽可能舒适的姿势仰卧位平躺于扫描舱内,并尽量保持头部不动。扫描范围包括颅顶至枕骨大孔水平。
快速梯度回波序列参数如下:重复时间为 8.6 ms,回波时间 为3.4 ms,翻转角度 12°,矩阵大小为 256×256,视野为240 mm×240 mm,层厚为1 mm,分辨率为 0.95 mm×0.95 mm,连续 164 个矢状面扫描。
3.一般人口学资料和汉语语音清晰度字表统计分析:比较两组受试者的一般人口学资料,包括年龄、性别,并对汉语语音清晰度字表进行统计分析。汉语语音清晰度字表包含字表Ⅰ和Ⅱ,每个字表包含100个字,可根据不同的异常语音反映出语音障碍的程度差异[11]。测试时所有CLP受试者需进行字表朗读并使用语音工作站进行同步录音,对于不识字者,由语音治疗师带读。由2名语音康复治疗师进行判听打分,按其所听的语音音节逐字进行记录,将记录的结果与字表逐一核对,找出患者异常的语音,计算审听结果的平均值,即每名测试者的汉语语音清晰度字表得分。得分与语音清晰度的关系如下:①重度,会话内容(≤35%)需反复试问才可勉强理解,患者发出的所有辅音几乎都难以听清;②中度,部分会话内容(36%~70%)不易理解;③轻度,大部分会话内容(71%~96%)基本容易理解。
健康对照组儿童在临床筛查中,由具有3年言语康复评估经验的言语康复医师及治疗师进行言语清晰度评估,语音清晰度正常者入组。
4. VBM:在Matlab2013b(MathWorks,Natick,MA,USA)环境下,使用统计参数图软件(statistical parametric mapping software12,SPM12,Wellcome Department of Cognitive Neurology,London,UK)的计算解剖学工具箱(computational anatomy toolbox 12,CAT12)对全脑高分辨率三维T1W(T1 weighted image,T1W)结构像数据进行测量。主要步骤如下:①磁场不均匀性校正,对图像强度进行归一化处理,应用空间自适应非局部均值滤波去躁。②仿射预处理和剔除非脑组织,对不均匀磁场校正后图像进行仿射变换,剔除非脑组织,并进行强度归一化处理以约束图像强度范围。③脑组织分割,应用局部自适应分割算法,完成在个体空间下灰质、白质和脑脊液组织图像分割。④空间标准化,应用DARTEL(diffeomorphic anatomical registration through exponentiated lie algebra)算法进行受试者脑组织图像从个体空间到蒙特利尔研究所(Montreal neurological institute,MNI)152 标准空间配准,脑组织图像空间分辨率重采样为1.5 mm× 1.5 mm×1.5 mm。⑤平滑,高斯平滑核半高宽(full width at half maximum,FWHM)=8 mm[12, 13]。所有图像预处理步骤均进行视觉质量检查。
5. SBM:在Matlab2013b(MathWorks,Natick,MA,USA)环境下,使用SPM12的CAT12对全脑高分辨率3DT1WI结构像数据进行SBM。SBM的核心是构建脑白质-灰质和灰质-脑脊液的边界模型,从而完成皮层厚度、皮层褶皱指数、分形维度系数、沟回深度等皮层表面形态结构指标的计算[14]。SBM分析主要关注端脑组织皮层形态结构,小脑组织不纳入SBM分析。主要步骤包括:①个体空间T1W进放射变换配准到MNI305空间,剔除非脑组织。②基于B1偏置场校正,估计白质组织信号强度变化,并基于脑白质组织主体对全脑进行场估计。③基于MNI305标准脑组织模板中白质分布及受试者个体空间下体素信号强度和空间位置对个体T1W图像中可能属于脑白质组织体素进行分类,即全脑体素被分为属于白质和不属于白质两类。每个体素信号强度除以对应偏置场估计值,以消除偏置场对体素强度的影响。④Talairach变形,将左右半球分开处理,每个半球生成一个初始球面,从基于体素的体积空间转换到基于顶点(Vertex)表面空间分析。通过强度梯度检测可分别实现白质-灰质和灰质-脑脊液(即硬脑膜表面)边界模型的构建,两边界间的距离即为灰质皮层厚度。此外,还可计算皮层折叠系数和分形维度系数实现对皮层折叠(Fold)模式的定量分析,以及皮层表面积指标[15]。SBM分析流程见图1。⑤平滑,皮层厚度指标选用高斯平滑核FWHM=15 mm,其他指标选用高斯平滑核FWHM=0 mm。
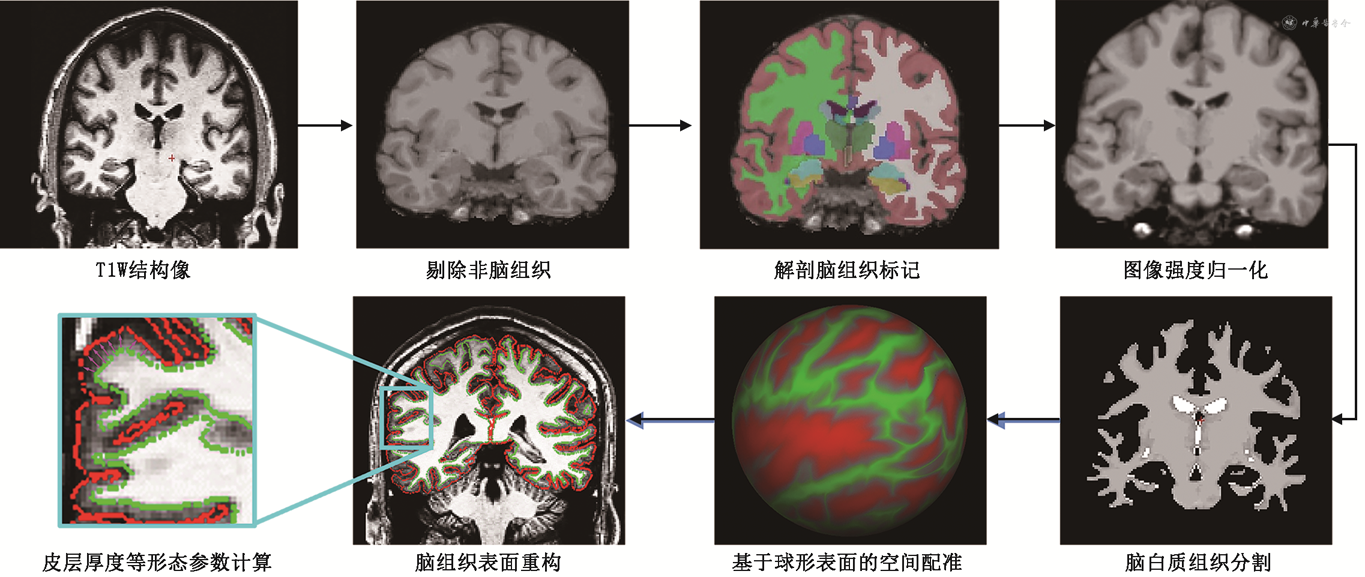

6.统计学分析:经K-S检验符合正态分布的定量资料采用“”表示,组间比较采用双样本t检验,定性资料采用χ²检验,以双侧P<0.05为差异有统计学意义。族错误率(family-wise error rate,FWER)是将单次比较情况下的P值除以整个实验的比较次数,用得到的新P值判断结果的显著性。
VBM使用CAT12和SPM12工具箱对比两组之间灰、白质体积的差异。采用双样本t检验进行组间比较,分析过程中去除协变量全脑体积、年龄和性别对组间统计的影响。采用高斯随机场多重比较校正方法对组间进行多重比较校正,以双侧P<0.05 为差异有统计学意义。
SBM采用 CAT12和SPM12 模块进行统计学分析。控制年龄和性别协变量,采用双样本t检验,团块水平采用FWE校正进行多重比较校正,以双侧t检验P<0.05 为差异有统计学意义,检验皮质厚度、折叠系数等皮层形态结构参数的组间差异。左右双侧半球分别进行比较。
1.一般人口学资料和汉语语音清晰度字表统计结果:健康对照组的年龄和性别与CLP组的差异均无统计学意义(t=-0.07,P=0.944;χ2=0.11,P=0.745)。CLP组受试者的汉语语音清晰度字表得分为(44.83±25.73)分,健康对照组的汉语语音清晰度评估是通过语音师临床主观筛查,无量表得分。
2.基于VBM分析的脑灰质体积比较:见图2及表1。与健康对照组相比,CLP组左侧颞下回、右顶下缘角回、左小脑上部灰质体积均显著减少(P<0.05),右内侧额上回体积显著增加(P<0.05)。
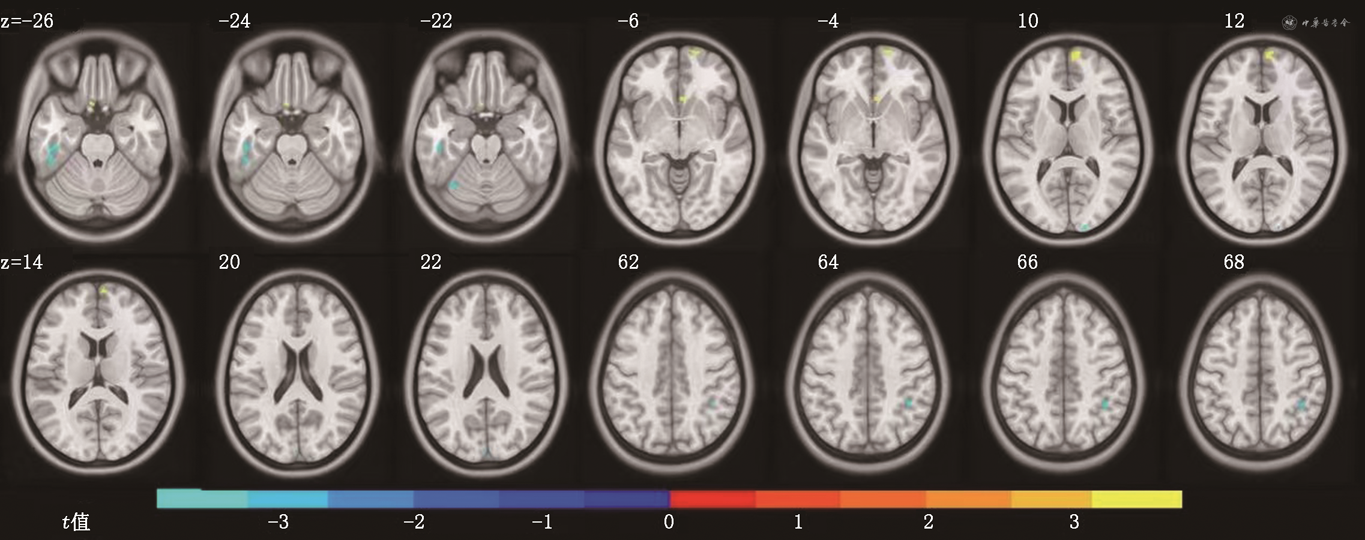

注:浅蓝及蓝色脑区表示与健康对照组相比,伴发腭裂言语障碍的唇腭裂组(CLP组)灰质显著萎缩的脑区;红-黄色表示与健康对照组相比,CLP组脑区的灰质体积异常增加;z为统计变量峰值对应体素的蒙特利尔神经研究所152空间坐标值
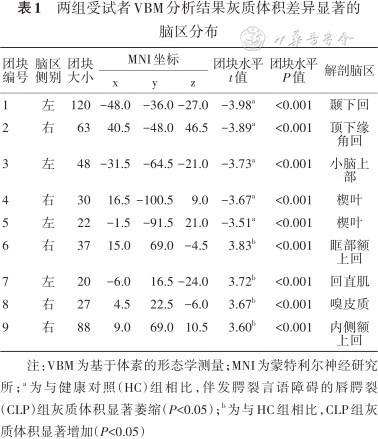
两组受试者VBM分析结果灰质体积差异显著的脑区分布
两组受试者VBM分析结果灰质体积差异显著的脑区分布
| 团块编号 | 脑区侧别 | 团块大小 | MNI坐标 | 团块水平 t值 | 团块水平 P值 | 解剖脑区 | ||
|---|---|---|---|---|---|---|---|---|
| x | y | z | ||||||
| 1 | 左 | 120 | -48.0 | -36.0 | -27.0 | -3.98a | <0.001 | 颞下回 |
| 2 | 右 | 63 | 40.5 | -48.0 | 46.5 | -3.89a | <0.001 | 顶下缘角回 |
| 3 | 左 | 48 | -31.5 | -64.5 | -21.0 | -3.73a | <0.001 | 小脑上部 |
| 4 | 右 | 30 | 16.5 | -100.5 | 9.0 | -3.67a | <0.001 | 楔叶 |
| 5 | 左 | 22 | -1.5 | -91.5 | 21.0 | -3.51a | <0.001 | 楔叶 |
| 6 | 右 | 37 | 15.0 | 69.0 | -4.5 | 3.83b | <0.001 | 眶部额上回 |
| 7 | 左 | 20 | -6.0 | 16.5 | -24.0 | 3.72b | <0.001 | 回直肌 |
| 8 | 右 | 27 | 4.5 | 22.5 | -6.0 | 3.67b | <0.001 | 嗅皮质 |
| 9 | 右 | 88 | 9.0 | 69.0 | 10.5 | 3.60b | <0.001 | 内侧额上回 |
注:VBM为基于体素的形态学测量;MNI为蒙特利尔神经研究所;a为与健康对照(HC)组相比,伴发腭裂言语障碍的唇腭裂(CLP)组灰质体积显著萎缩(P<0.05);b为与HC组相比,CLP组灰质体积显著增加(P<0.05)
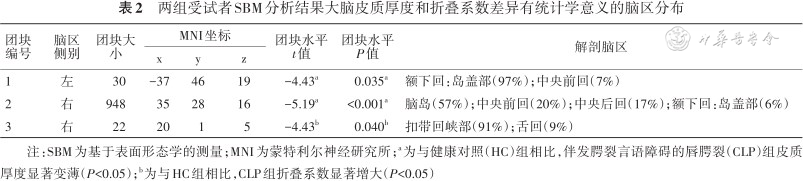
3. 基于SBM分析的组间皮质厚度和折叠系数差异:见图3及表2。与健康对照组对比,CLP组受试者的左侧额下回岛叶部、右侧脑岛部皮质厚度显著变薄(FWE校正,P=0.035)。与健康对照组对比,CLP组右侧半球扣带回峡部折叠系数增大(FWE校正,P=0.040)。
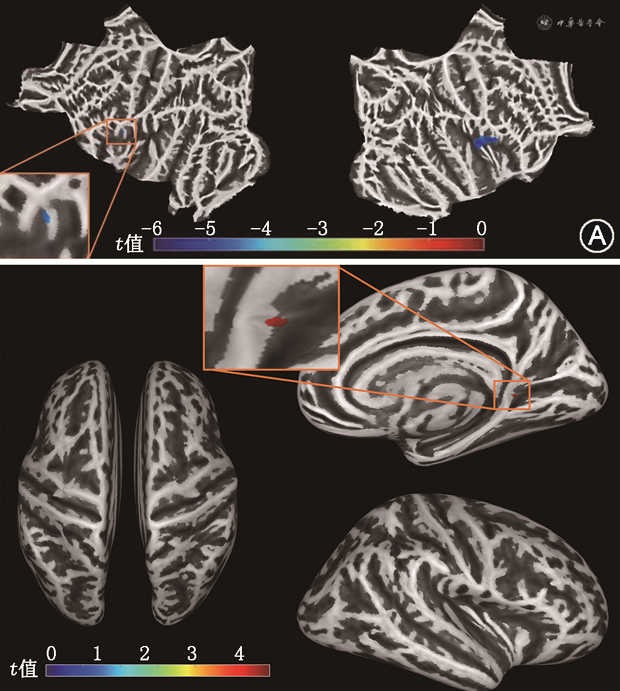

注:图例为t值,即族错误率校正后P<0.05
两组受试者SBM分析结果大脑皮质厚度和折叠系数差异有统计学意义的脑区分布
两组受试者SBM分析结果大脑皮质厚度和折叠系数差异有统计学意义的脑区分布
| 团块编号 | 脑区侧别 | 团块大小 | MNI坐标 | 团块水平t值 | 团块水平P值 | 解剖脑区 | ||
|---|---|---|---|---|---|---|---|---|
| x | y | z | ||||||
| 1 | 左 | 30 | -37 | 46 | 19 | -4.43a | 0.035a | 额下回:岛盖部(97%);中央前回(7%) |
| 2 | 右 | 948 | 35 | 28 | 16 | -5.19a | <0.001a | 脑岛(57%);中央前回(20%);中央后回(17%);额下回:岛盖部(6%) |
| 3 | 右 | 22 | 20 | 1 | 5 | -4.43b | 0.040b | 扣带回峡部(91%);舌回(9%) |
注:SBM为基于表面形态学的测量;MNI为蒙特利尔神经研究所;a为与健康对照(HC)组相比,伴发腭裂言语障碍的唇腭裂(CLP)组皮质厚度显著变薄(P<0.05);b为与HC组相比,CLP组折叠系数显著增大(P<0.05)
为最大程度恢复CLP儿童人群的言语功能,目前腭裂手术通常在患儿出生后8~18个月进行,以便在语音发育期前恢复CLP儿童的腭部结构,使其可以像正常儿童一样进行语音发育。但腭裂术后的CLP儿童人群的言语功能恢复仍不尽如人意,存在不同程度的言语问题[16]。其中5岁CLP儿童人群言语障碍的发生率为30%~40%[17],20%~30%的CLP儿童在7岁时仍存在言语问题,表现为以声门塞音为主要典型特征的腭裂语音障碍。汉语语音清晰度测试字表为了客观评价患者语音障碍程度,根据临床上语音患者最易频繁出现的异常语音而设计制成的字表,是目前广泛用于临床评估CLP人群语音清晰度的量表之一。CPSD对 CLP儿童的沟通表达、情绪及社会交际方面造成严重不良影响[18, 19]。因此,CPSD的产生机制受到临床医师及相关学者的关注,随着MRI技术的发展及其在言语障碍机制研究中的广泛应用,为CPSD的神经病理机制研究提供了新的研究思路。
CPSD人群的神经影像学研究是近年学界关注的研究热点,研究多集中于CPSD成年人群,针对CPSD儿童人群的相关研究鲜见报道。本研究是国内首次对伴发CPSD的CLP儿童人群脑结构进行研究,利用MRI技术探索CPSD人群脑形态学指标变化。CPSD儿童人群的脑结构异常主要表现为大脑和小脑体积的异常减少,尤其双侧额叶和皮质下核团体积的显著减小[7,20]。本研究结果初步从脑结构神经影像学方面对CLP儿童的CPSD产生机制进行探索。本研究基于VBM分析结果表明,与性别、年龄相匹配的健康对照组相比,伴发CPSD的CLP组左侧颞下回、右顶下缘角回、左小脑上部灰质体积显著减少,右内侧额上回的灰质体积显著增加。颞下回主要与语言理解、决策等语言功能相关[21, 22]。角回位于顶枕叶交界处,是视觉性语言中枢,主要与单词的视觉记忆密切相关[23]。如果角回受损,对单词视觉意象与听觉意象关联造成影响,可使患者对书面语言的理解造成困难。左侧小脑上部主要参与语言功能流畅性(包括语义和形式)[24]。语言的脑内形成阶段,声音通过听觉中枢到达感觉性语言中枢,在颞下回形成语义(语言符号及编码)。而视觉信息则通过视觉中枢到达角回及缘上回,形成视觉忆痕。因此,伴CPSD的CLP组左侧颞下回、右顶下缘角回、左小脑上部灰质体积显著减少,可能是导致CLP儿童人群语义理解、理解性与表达性词汇技能落后的神经病理学基础[25, 26]。
岛叶与语言产生关系密切,岛叶功能主要与介导言语产生的运动方面相关[27],特别是发音控制在进行言语产生如复述或朗读时,主要由左前岛叶和Broca区制订发音计划,将语音编码转换成发声的肌肉运动程序,并执行这一程序。脑岛是位于大脑外侧裂内部的一块皮层组织[28],右侧脑岛被认为可能在言语的运动控制中起重要作用。皮质厚度受神经元排列和密度的影响,是脑发育程度的主要定量指标。CLP组受试者的左侧额下回岛叶部,右侧脑岛部皮质厚度显著变小,可能与CLP的特征性腭裂语音障碍不良发音习惯相关,伴发CPSD的CLP患者发音时,其言语产生的肌肉运动模式异于健康者[29]。CLP患者常表现为用舌根与咽后壁接触形成舌咽闭合,或用舌体堵塞腭部裂隙,或用声门部挤压对发音气流进行控制,使其能发出相对易懂的声音。
右侧扣带回是汉语语言加工的特殊脑功能区之一[30],其是朗读非拼音文字的功能区,与汉字语义加工功能相关。CLP组的右扣带回峡部折叠系数增大,可能与伴发CPSD的CLP儿童代偿性不良发音习惯相关,其非拼音功能加强,进而导致结构发生改变。本研究中CLP组灰质体积减小的脑区与皮质厚度减小的脑区不同,其原因可能是与皮质表面积的双向改变相关。本研究为进一步探索两组受试者差异结果的组内分布情况,分别提取每名受试者不同脑结构指标参数比较中差异脑区的指标均值,组内比较显示差异脑结构指标在两组受试者中均显示较高的组内一致性。
综上所述,伴发腭裂言语障碍的CLP儿童的全脑灰质结构的多参数分析结果显示异常。与健康儿童相比,CLP儿童确实存在多个语言相关脑区灰质体积减小、皮质厚度减小及折叠系数增加,本研究结果基于多维度的灰质形态学分析,为CLP儿童的言语障碍发病机制提供客观脑形态学依据。伴发CPSD的CLP儿童存在多个语言相关脑区灰质体积减小、皮质厚度减小、折叠系数增大,这些与CLP人群特有的腭裂言语障碍的相关性尚需进一步深入研究。目前脑影像学研究中,对言语障碍相关的脑功能、灰质结构等指标的检测及脑灰质体积的变化为受损的金标准尚缺乏,主要是依赖设计对照实验[31, 32],运用统计学方法的差异表达,且目前尚无方法验证脑灰质体积变化对相应功能的影响,有待于进一步研究。
所有作者声明不存在利益冲突
腭裂是一种发生在腭部的先天性畸形,由于口鼻腔相通造成的腭咽闭合不全严重影响了语音的质量和清晰程度。手术是治疗腭裂的主要方法,但仍有10%~40%的患者术后遗留语音问题。腭裂语音及康复问题成为众多研究焦点之一。随着科学技术的进步,研究者们已将看似单一的问题携手多学科加以解决。腭裂的语音障碍也是如此,看似构音的问题,却与语言的发育及脑部特定部位的形态密不可分。《腭裂言语障碍儿童语言相关脑区灰质形态学分析》一文,作者通过分析腭裂患儿和健康儿童的磁共振三维T1结构像序列扫描结果得出以下结论:伴发腭裂言语障碍的唇裂合并腭裂儿童存在多个语言相关脑区的灰质改变,包括灰质体积减小、皮质厚度减小及折叠系数增大等。与健康儿童对比,相关脑区灰质形态学的改变可能与腭裂患儿特有的腭裂言语障碍相关。本文的创新性体现在将腭裂儿童构音的言语问题与语言相关的脑部灰质形态联系起来,通过脑部磁共振的方法观察分析,跳出了单纯的构音障碍的圈子,为进一步探讨腭裂语音产生的机制提出新的思路。
本研究还应在以下几方面进行更深入的探讨:①扩大样本量,缩小受试者年龄跨度;②设法确定脑灰质体积变化的功能意义以及言语障碍的脑组织结构变化标准;③在后续研究中对所得结果应尽可能进行全面的解释和详尽的讨论,以突出研究的意义及其临床应用价值。



























