
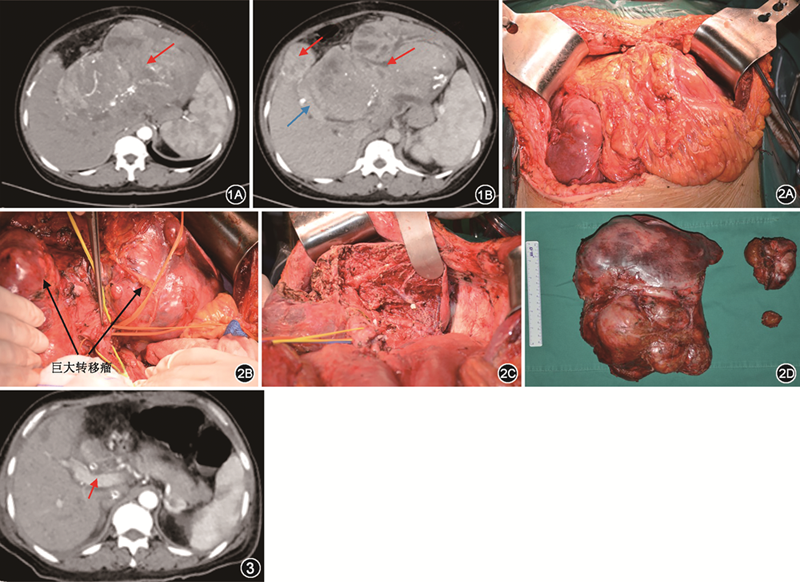
患者 女性,44岁,因“颅内孤立性纤维性肿瘤/血管外皮瘤(solitary fibrous tumors/hemangiopericytoma,SFT/HPC)术后13年,伴肺、肝、肾等多发转移5年,反复低血糖发作半年”于2019年9月22日收入清华大学附属北京清华长庚医院肝胆胰中心。患者13年前因头痛、头晕、恶心、呕吐等不适就诊于外院,诊断为右枕部颅内肿瘤,行颅内肿瘤切除术。切除标本的病理学检查结果显示,灰白色组织,大小5 cm ×5 cm×4 cm;免疫组化检查结果显示,波形蛋白(+++)、CD99(++)、EMA(-)、CD34(-);病理学诊断为右枕血管外皮细胞型脑膜瘤(Ⅱ级)。患者术后行头颅立体放疗一次。5年前复查见双肺多发转移瘤,最大者位于左肺上叶,大小约3.0 cm×5.0 cm,于外院行胸腔镜下左肺楔形切除术,术后病理学检查结果为硬化性血管瘤。患者3年前复查见肝左叶转移瘤,大小约13.0 cm×11.0 cm×9.5 cm,于外院行肝组织穿刺活检术,术后病理学检查结果为倾向转移性颅内SFT/HPC。请解放军总医院第一医学中心病理科会诊,将第一次颅内肿瘤术后病理学检查修正诊断为颅内SFT/HPC,后两次病理学检查结果均为颅内SFT/HPC转移。随后患者于外院行开腹肝左叶肿瘤切除术,术后病理学检查结果为颅内SFT/HPC肝转移。患者2年前复查见左肾转移瘤,大小约4.0 cm×5.0 cm,于外院行腔镜下左肾转移瘤切除术,术后病理学检查结果为颅内SFT/HPC肾转移。患者半年前出现反复发作的低血糖,CT检查结果示肝脏巨大转移瘤,左肾和肺多发转移瘤,分别于2019年4月、2019年5月、2019年7月于外院行肝动脉+膈动脉化疗栓塞术,前两次使用多柔比星+碘化油,后一次使用博来霉素+碘化油。治疗后肝左叶肿瘤最大径由原来的约17 cm增至约25 cm,且每次介入治疗后血糖仅可维持正常水平3~5 d,然后再次出现反复发作的低血糖,发作频率逐渐增至约3.5 h发作一次,发作时血糖低至1 mmol/L,时有昏迷,夜间需进食2~3次。患者入院前一般情况尚可,小便正常,无其他慢性病史。入院体检:心率123 次/min,体温、呼吸、血压等正常。腹部外形膨隆,反L形手术切口愈合好,上腹部可触及巨大肿块,约达剑突下20 cm,边界不清,固定,质地硬,表面不光滑。血糖化血红蛋白、空腹胰岛素均低于正常值范围。腹部CT平扫见肝内多发大小不等肿块影,左肝为著,最大径约24.2 cm×13.3 cm,内见多发斑片状阴影及结节影;腹部CT增强扫描见实性部分强化,分别由肝动脉及膈动脉分支供血。门静脉增粗,最宽处约24 mm,门静脉左支及分支显示不清(图1)。左肾和双肺也可见多发肿块影,最大径约5 cm,密度不均匀,增强扫描可见不均匀强化。完善相关术前准备,患者和家属签署手术同意书后行手术治疗,术中见肿瘤位于左肝及部分肝脏右前叶,大小约25 cm×20 cm×15 cm,肝脏6段腹侧和背侧各见一个肿瘤,大小分别为7.0 cm×6.6 cm×6.0 cm和3.0 cm×3.0 cm×1.5 cm。肿瘤质韧,表面光滑,呈大结节样改变。肿瘤活动度极差,占位效应明显,游离困难(图2)。行扩大左半肝切除术,手术时间约17 h,出血量约10 000 ml,静脉滴注红细胞20 U、血浆3 200 ml,术中血压维持困难,需大量升压药维持。患者术后出现发热,体温最高达39 ℃,血常规检查示白细胞计数最高达32.85×109/L,中性粒细胞占比91%,痰液培养出白色念珠菌,给予亚胺培南、利奈唑胺和氟康唑等多种抗菌药物治疗后好转。患者术后清醒后出现反复发作的抽搐和对答不正确,头颅增强MRI检查结果见脑内多发异常强化灶,考虑转移。请神经内科和神经外科会诊后,给予左乙拉西坦片后患者病情好转。患者术后复查腹部增强CT,肝内未见肿瘤残余,门静脉右支内径正常,无受压及血栓形成(图3)。患者术后未再出现低血糖发作,术后第19天出院。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者 女性,44岁,因“颅内孤立性纤维性肿瘤/血管外皮瘤(solitary fibrous tumors/hemangiopericytoma,SFT/HPC)术后13年,伴肺、肝、肾等多发转移5年,反复低血糖发作半年”于2019年9月22日收入清华大学附属北京清华长庚医院肝胆胰中心。患者13年前因头痛、头晕、恶心、呕吐等不适就诊于外院,诊断为右枕部颅内肿瘤,行颅内肿瘤切除术。切除标本的病理学检查结果显示,灰白色组织,大小5 cm ×5 cm×4 cm;免疫组化检查结果显示,波形蛋白(+++)、CD99(++)、EMA(-)、CD34(-);病理学诊断为右枕血管外皮细胞型脑膜瘤(Ⅱ级)。患者术后行头颅立体放疗一次。5年前复查见双肺多发转移瘤,最大者位于左肺上叶,大小约3.0 cm×5.0 cm,于外院行胸腔镜下左肺楔形切除术,术后病理学检查结果为硬化性血管瘤。患者3年前复查见肝左叶转移瘤,大小约13.0 cm×11.0 cm×9.5 cm,于外院行肝组织穿刺活检术,术后病理学检查结果为倾向转移性颅内SFT/HPC。请解放军总医院第一医学中心病理科会诊,将第一次颅内肿瘤术后病理学检查修正诊断为颅内SFT/HPC,后两次病理学检查结果均为颅内SFT/HPC转移。随后患者于外院行开腹肝左叶肿瘤切除术,术后病理学检查结果为颅内SFT/HPC肝转移。患者2年前复查见左肾转移瘤,大小约4.0 cm×5.0 cm,于外院行腔镜下左肾转移瘤切除术,术后病理学检查结果为颅内SFT/HPC肾转移。患者半年前出现反复发作的低血糖,CT检查结果示肝脏巨大转移瘤,左肾和肺多发转移瘤,分别于2019年4月、2019年5月、2019年7月于外院行肝动脉+膈动脉化疗栓塞术,前两次使用多柔比星+碘化油,后一次使用博来霉素+碘化油。治疗后肝左叶肿瘤最大径由原来的约17 cm增至约25 cm,且每次介入治疗后血糖仅可维持正常水平3~5 d,然后再次出现反复发作的低血糖,发作频率逐渐增至约3.5 h发作一次,发作时血糖低至1 mmol/L,时有昏迷,夜间需进食2~3次。患者入院前一般情况尚可,小便正常,无其他慢性病史。入院体检:心率123 次/min,体温、呼吸、血压等正常。腹部外形膨隆,反L形手术切口愈合好,上腹部可触及巨大肿块,约达剑突下20 cm,边界不清,固定,质地硬,表面不光滑。血糖化血红蛋白、空腹胰岛素均低于正常值范围。腹部CT平扫见肝内多发大小不等肿块影,左肝为著,最大径约24.2 cm×13.3 cm,内见多发斑片状阴影及结节影;腹部CT增强扫描见实性部分强化,分别由肝动脉及膈动脉分支供血。门静脉增粗,最宽处约24 mm,门静脉左支及分支显示不清(图1)。左肾和双肺也可见多发肿块影,最大径约5 cm,密度不均匀,增强扫描可见不均匀强化。完善相关术前准备,患者和家属签署手术同意书后行手术治疗,术中见肿瘤位于左肝及部分肝脏右前叶,大小约25 cm×20 cm×15 cm,肝脏6段腹侧和背侧各见一个肿瘤,大小分别为7.0 cm×6.6 cm×6.0 cm和3.0 cm×3.0 cm×1.5 cm。肿瘤质韧,表面光滑,呈大结节样改变。肿瘤活动度极差,占位效应明显,游离困难(图2)。行扩大左半肝切除术,手术时间约17 h,出血量约10 000 ml,静脉滴注红细胞20 U、血浆3 200 ml,术中血压维持困难,需大量升压药维持。患者术后出现发热,体温最高达39 ℃,血常规检查示白细胞计数最高达32.85×109/L,中性粒细胞占比91%,痰液培养出白色念珠菌,给予亚胺培南、利奈唑胺和氟康唑等多种抗菌药物治疗后好转。患者术后清醒后出现反复发作的抽搐和对答不正确,头颅增强MRI检查结果见脑内多发异常强化灶,考虑转移。请神经内科和神经外科会诊后,给予左乙拉西坦片后患者病情好转。患者术后复查腹部增强CT,肝内未见肿瘤残余,门静脉右支内径正常,无受压及血栓形成(图3)。患者术后未再出现低血糖发作,术后第19天出院。

切除标本肉眼可见紧邻肝脏切缘和肝门断端有一个巨大肿瘤,大小约24 cm×19 cm×11 cm,肿瘤切面颜色为灰黄、灰粉和灰褐色,大部分呈鱼肉状,质软,局部有囊腔,直径0.1~4.0 cm,内有血凝块,部分囊腔内可见灰黄色胶冻样物。肿瘤周围可见2个卫星灶,大小分别为1.4 cm×1.4 cm×0.5 cm和1.4 cm×0.8 cm×0.8 cm。肝脏6段腹侧和背侧肿瘤大小分别约7.0 cm×6.6 cm×6.0 cm和3.0 cm×3.0 cm×1.5 cm,剖开后肉眼观同前。镜下描述:肝肿瘤细胞呈短梭形,核分裂象2个/10个高倍视野,大小一致,细胞密集,无特定排列,其中可见大量裂隙样血管,内衬扁平内皮细胞,部分血管分支呈鹿角状,部分区域囊性变,局部可见出血及大片坏死,纤维组织增生。未见明确脉管内瘤栓及神经侵犯,未累及肝脏切缘、肝门区及肝被膜。免疫组化结果提示,波形蛋白、CD34、CD31、STAT6均为阳性,凝血因子 散在灶性阳性,Ki-67为10%阳性,CD99弱阳性,EMA散在个别细胞弱阳性,SMA、S-100、PR和Desmin均阴性。结合病史,符合肝脏转移性颅内SFT/HPC(Ⅰ级)。
散在灶性阳性,Ki-67为10%阳性,CD99弱阳性,EMA散在个别细胞弱阳性,SMA、S-100、PR和Desmin均阴性。结合病史,符合肝脏转移性颅内SFT/HPC(Ⅰ级)。
患者术后2个月时开始服用靶向药物索拉非尼,效果差,肺及肾的转移瘤进行性增大。患者术后半年在外院行肺和肾转移瘤微波消融术,但病情仍继续进展。2021年7月患者出现神志不清、呼吸困难及肾功能异常,病情逐渐加重。随访至2021年8月,患者因脑部肿瘤复发及肺、肾功能衰竭死亡。患者术后一直未再发生低血糖,肝脏未见复发征象。
SFT/HPC是一种来源于树突状间叶组织的梭形细胞肿瘤。既往认为,SFT和HPC是两种不同类型的肿瘤,但近年来研究发现,SFT和HPC不仅在生物学行为方面有相似之处,且在分子病理学特征方面亦有重叠。2016年WHO中枢神经系统肿瘤分类第4版中,将这两种肿瘤合并为同一个名称,即SFT/HPC[1]。它是一种少见的肿瘤,可发生在人体各个部位,好发于颅内、躯干、腹盆腔等处,国内外均少有报道。根据病理学形态及核分裂象,WHO将SFT/HPC分为Ⅰ、Ⅱ、Ⅲ级:Ⅰ级为良性肿瘤,细胞密度较低,排列较为松散,预后良好;Ⅱ级为低度恶性肿瘤,细胞密度高,排列较为致密,核分裂象<5个/10个高倍视野,间质出现“鹿角样”血管;Ⅲ级为恶性程度较高肿瘤,病理学检查可见细胞密集区和疏松区,密集区有多发核分裂象(≥5个/10个高倍视野),或伴有肿瘤坏死或中度至重度核异型性细胞。
原发性中枢神经系统SFT/HPC的治疗首选手术完整切除,患者术后预后较好,但复发率较高,尤其对于肿瘤分级较差的Ⅱ级及Ⅲ级患者[2]。此外,颅外转移亦较常见,常见于骨(19.6%),其次是肺和胸膜(18.4%)、肝脏(17.6%)[3]。但肿瘤复发和转移机制仍不完全清楚,有学者发现当肿瘤最大径>5 cm、细胞核分裂象>4个/10个高倍视野或有TP53和TERT启动因子突变时具有恶性表现,易复发和转移[4, 5]。近年来研究发现,WNT5A、MMP-9和PD-L1在颅内SFT/HPC中高表达[6, 7],这些分子通过信号转导通路有促进血管侵袭和远处转移的能力,可能与颅内复发和颅外转移有关,其分子靶向治疗有望延缓颅内SFT/HPC的复发和转移。由于颅内SFT/HPC易复发和转移,多数文献报道其术后联合辅助放疗可延长复发和转移时间,因此,目前多数学者主张不论肿瘤是否全切除,术后均应行放疗[8]。但术后辅助放疗的效果仍存一些争议,有文献报道术后辅助放疗可延缓颅内肿瘤的复发,但并未延长患者的总体生存期[9, 10]。
SFT/HPC在颅内及颅外转移病灶(如肝、肺、肾等)中,其病理学特点基本一致,镜下HE染色均表现为形态大小较一致的短梭形细胞,细胞核卵圆形,无特异性;瘤细胞间见鹿角样血管,呈条束状、鱼骨样排列;核分裂象数量不等,可见多灶坏死。网织纤维染色可见丰富的网状纤维围绕单个肿瘤细胞或肿瘤细胞团[11, 12]。免疫组化染色STAT6在诊断SFT/HPC方面具有较高的特异度和灵敏度,可作为SFT/HPC的诊断标准;此外,SFT/HPC中的CD99、Bcl-2、CD34、波形蛋白也常表达阳性,可作为有效补充[13]。本病例HE染色显示肝肿瘤细胞呈短梭形,大小一致,排列密集,其中可见大量裂隙样血管,部分血管分支呈鹿角状,核分裂象2个/10个高倍视野,局部可见出血及大片坏死;同时免疫组化检测结果提示,波形蛋白、CD34、CD31、STAT6的表达均为阳性,凝血因子 散在灶性阳性,Ki-67为10%阳性,CD99弱阳性,EMA散在个别细胞弱阳性,S-100、SMA、PR、Desmin均阴性,可诊断为肝脏转移性颅内SFT/HPC。
散在灶性阳性,Ki-67为10%阳性,CD99弱阳性,EMA散在个别细胞弱阳性,S-100、SMA、PR、Desmin均阴性,可诊断为肝脏转移性颅内SFT/HPC。
肝脏转移性颅内SFT/HPC在CT和MRI中无特异性影像学特点,主要表现为肝内多发结节与肿块,增强呈不均匀强化,肿瘤巨大时伴有片状坏死[12]。本病例的CT增强检查图像可见肝内多发大小不等结节影,病变可相互融合、密度不均匀,内可见多发血管影,呈不均匀性强化,有多发坏死灶。肺和肾转移肿瘤和肝转移影像学表现基本一致,均无特异性。该疾病临床表现亦无特异性,肿瘤巨大时可有占位性表现,如上腹部巨大肿块,伴有胀痛、饮食差等;极少数患者可有低血糖、高血压、杵状指/趾等副肿瘤综合征表现[14]。本例患者有严重的低血糖表现,平均每3.5小时即需进食一次,严重影响了生活质量。其低血糖可能是因为肿瘤细胞过度高表达血清胰岛素样生长因子-Ⅱ后,该因子可与胰岛素受体、胰岛素样生长因子-Ⅰ受体结合引起内源性胰岛素效应而增加机体及肿瘤对葡萄糖的利用[15],同时也会抑制生长激素的分泌,使生长激素介导的血糖调节机制受损,最终导致难以纠正的严重低血糖。
目前关于颅外转移性SFT/HPC的治疗方法报道较少,多数学者认为外科手术是其首选治疗方式[16, 17]。对颅外转移性SFT/HPC进行放疗的研究较少。van Houdt等[18]研究发现,在颅外转移性SFT/HPC肿瘤中,放疗无明显效果;但Haas 等[19]研究却发现,放疗对40例SFT/HPC患者的效果较好。有报道,在无法切除的肝脏原发SFT/HPC患者中应用以多柔比星为基础的肝动脉化疗栓塞术治疗,可有效抑制转移瘤生长[20]。同样,Velayati等[21]研究发现,在肝脏转移性SFT/HPC患者中应用肝动脉栓塞术亦取得了良好的临床效果,12例患者的中位总体生存期达到4年,且能有效治疗副肿瘤综合征中的低血糖。但我们发现,本例患者术后接受放疗后,出现了肺、肾、肝等多发转移,给予多次肿瘤切除后仍很快复发,且伴有严重的低血糖表现。两次应用博来霉素和多柔比星介入化疗后肝脏肿瘤进行性增大,血糖仅稳定3~5 d,效果较差,考虑可能与肿瘤丰富的血供和体积巨大有关,也可能与肿瘤对化疗不敏感有关。本例患者行肝肿瘤切除术后血糖即刻恢复了正常,未再发生低血糖,这表明外科手术是恢复血糖的有效方法。患者术后2年死于脑、肾、肺等多器官转移,再次证实该疾病虽然生长缓慢,但复发率极高,长期预后较差[22]。近年来抗血管生成靶向药物开始用于治疗原发性和转移性SFT/HPC,效果优于传统化疗方案[23, 24],但总体效果不理想。本病例的治疗过程显示,患者术后口服靶向药物索拉非尼治疗,病情仍进展较快,效果欠佳,因此需要进一步寻找有效的分子靶点和治疗方法。
所有作者声明不存在利益冲突


























