
日间过度思睡(EDS)困扰着超过20%的人群,它不但影响着个体多方面的表现,甚至还可能因潜在的风险而危及生命。然而目前国内外尚无针对EDS全面的诊疗规范。为此,中国睡眠研究会组织国内睡眠医学专家,以国内外最新的研究进展为依据,制订本专家共识,针对EDS的定义、流行病学、临床表现、诊断思路及相关病因、评估和治疗进行逐一阐述,以期为EDS的诊疗提供全面而规范化的参考和建议。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在现代社会生活中,保持清醒的能力是维持健康生活和社会功能所必需的。日间过度思睡(excessive daytime sleepiness,EDS)是指个体在白天无法保持应有的清醒和警觉,出现过度的睡眠需求甚至不自主地入睡。EDS影响个体多方面的表现,造成学习能力下降、家庭和职业角色表现不佳,并因潜在的交通事故风险而威胁生命。流行病学研究发现,超过20%的人群受到EDS的困扰[1, 2],但其定义、评估方法和处理存在差异,从而延误诊断和治疗。
鉴于EDS的高发性和危害性,加之国内外尚无针对EDS全面的诊疗规范,中国睡眠研究会组织国内睡眠医学领域专家,以国内外最新的研究进展为依据,结合我国实际,经过反复交流和探讨,制订本专家共识,以期为EDS的诊疗提供全面而规范化的参考和建议。本共识主要包含以下临床问题:EDS的定义及相关概念;不同性别和年龄段人群EDS的患病率、共病及影响;EDS的临床表现;EDS的诊断思路及相关病因;EDS评估方法的选择;EDS及相关疾病的治疗手段。
本共识的编制采用会议共识法。2022年6—12月,由中国睡眠研究会组织国内睡眠医学领域的相关专家,成立EDS临床诊疗专家共识编写委员会(以下简称“编委会”),并由其中的7名成员执笔撰写。编委会成员系统检索了PubMed、EMBASE、Cochrane Library、中国知网、万方数据库和中国生物医学文献数据库等国内外主要数据库从建库到2022年6月发表的文献,检索词为“sleepiness”“(excessive)daytime sleepiness”“drowsiness”“hypersomnia”“hypersomnolence”“思睡”“日间/白天(过度)思睡/嗜睡”“困倦”“嗜睡”“睡眠增多”及EDS相关疾病(如中枢性嗜睡、发作性睡病、特发性嗜睡症、复发性嗜睡症、睡眠呼吸障碍、阻塞性睡眠呼吸暂停、失眠症、睡眠不足综合征、昼夜节律相关睡眠-觉醒障碍等)的定义、流行病学、临床表现、诊断、评估、治疗等方面的关键词。纳入的文献类型包括临床实践指南、专家共识、综述、荟萃分析和原始临床研究(如随机对照试验、非随机性研究、队列研究、病例对照研究、横断面研究、病例系列报道等)。编委会成员首先对纳入的文献进行证据等级分级,随后在此基础上进行推荐强度分级。此外,编委会还参考了《睡眠障碍国际分类》(第3版)(International Classification of Sleep Disorders,3rd edition,ICSD-3)、《睡眠医学理论与实践》(第7版)、《睡眠医学》(第2版)以及Up To Date中EDS及其相关疾病的最新内容和文献评价结果。共识中的一些重要领域可能无法在既往文献中找到理想依据,则需编委会成员基于临床经验进行判断、形成共识。本共识经过三次会议讨论,形成初稿,此后又经过三轮修改,提交编委会全体成员审核、讨论。随后又经过两轮修改,最终形成定稿。
本共识中的证据等级和推荐强度根据中华医学会发布的《中国制订/修订临床诊疗指南的指导原则(2022版)》,采用下列标准进行分级(表1、2)[3, 4]。

证据等级与定义
证据等级与定义
| 证据等级 | 说明 |
|---|---|
| Ⅰ级 | 至少一个设计合理的随机对照试验 |
| Ⅱ级 | 至少一个设计良好的非随机临床试验,队列或病例对照,分析研究,多个时间序列研究,或有显著成效的非对照试验 |
| Ⅲ级 | 学术权威、临床经验、描述性研究或专家委员会的报告 |
注:Ⅰ级最强

推荐强度与定义
推荐强度与定义
| 推荐强度 | 说明 |
|---|---|
| A级 | 有很好的证据支持使用:临床医师应该坚持遵守(要求至少一项有说服力的Ⅰ级研究或至少两项结果一致、可信的Ⅱ级研究) |
| B级 | 适当的证据支持使用:临床医师大部分情况下应该遵守(要求至少一项可信的Ⅱ级研究或大量的Ⅲ级证据) |
| C级 | 缺少证据支持或拒绝使用:临床医师可以参考或不参考该建议(要求至少两项可信的Ⅲ级证据) |
| D级 | 中度的证据反对使用:临床医师应该避免使用 |
| E级 | 大量证据反对使用:临床医师应该避免使用 |
注:A级最强
现阶段所编制的是专家共识而非指南,是由于目前学界针对EDS整体领域的关注程度有限,相关研究的证据不足,无法达到指南编制所需的文献证据等级的要求。因此,编委会成员基于现有文献证据,结合专家的临床经验,通过讨论形成共识,以指导EDS的临床诊疗实践。
本共识所提出的EDS的诊疗思路,既适用于各种存在EDS的睡眠障碍,也可用于其他存在EDS的疾病和障碍。本共识面向所有涉及EDS诊疗的临床工作者,既适用于睡眠医学及相关专业人员,也适用于非睡眠医学专业人员。
1. EDS:是指在一天需要保持清醒的时间段内无法维持清醒和警觉,出现不能抑制的睡眠需求,甚至不由自主地进入睡眠,可伴注意力和记忆力减退[5]。在这里sleepiness译作“思睡”而非“嗜睡”,以区别于昏睡(stupor)、嗜睡(lethargy)和意识混沌(obtundation)等因脑干上行网状激活系统、皮质广泛区域的结构和功能障碍而造成的介于清醒与昏迷之间的意识障碍状态[本共识所采用术语,均与全国科学技术名词审定委员会公布的《睡眠医学名词》[6]保持一致,故文中部分疾病名称(如中枢性嗜睡、特发性嗜睡症、复发性嗜睡症、药物或物质所致嗜睡症)及问卷名称(如“艾普沃斯嗜睡量表”“斯坦福嗜睡量表”“儿童日间嗜睡量表”)保留《睡眠医学名词》中的“嗜睡”表述]。
根据ICSD-3的定义,EDS几乎每天发生并连续至少3个月时,具有特殊临床意义,是诊断多种中枢起源的睡眠增多症的必要条件[5]。但某些特殊原因所致的EDS,如睡眠剥夺,或者药物(如镇静催眠药物、某些降压药物、抗帕金森病药物等)所致的日间思睡可以短期内突然发生。
2. 睡眠增多(hypersomnolence):常用于描述困倦、昏昏欲睡的主观感受;总睡眠量增多,客观上无法让患者保持长时间清醒的症状;以及睡眠无修复感的状态。通过延长睡眠时间,通常无法改变患者困倦的症状。根据ICSD-3的定义,以睡眠增多为核心症状的睡眠障碍称睡眠增多症(hypersomnia),如特发性睡眠增多症[5]。
3. 睡眠发作(sleep attack):多数情况下EDS发生于安静、久坐、单调枯燥的场景下,患者在入睡前能意识到自己的困倦。但有些EDS患者在没有任何预警的情况下会突然睡着,称为睡眠发作,常见于发作性睡病,也可见于使用非麦角类多巴胺受体激动剂的帕金森病患者[5,7]。
4. 疲劳(fatigue):指主观感觉体力和精力的缺乏,难以启动活动,或维持日常需求的活动困难。临床疲劳症状由三种成分按照不同比例构成:(1)启动活动困难:即个体主观感觉全身乏力,而客观检查无肌无力的体征,但开始活动发生困难;(2)维持活动困难:在活动中容易产生疲劳而更早需要休息;(3)精神疲劳:集中注意力困难,记忆力和情绪稳定性下降[8, 9]。
在病史采集中,患者可能使用疲劳、无力、精力不足、犯困、容易睡着等词汇来描述EDS症状。正确区分上述概念对于疾病诊断的导向有重要意义。另一方面,睡眠障碍或多种躯体疾病患者也存在上述症状的重叠,诊疗时应加以鉴别。治疗方法得当,上述症状可相应得到缓解。
EDS的患病率因调查对象和判断标准的不同而有很大差异。Young[10]综述欧美为主的普通人群的大样本流调资料,发现EDS的患病率为2.5%~52.4%,两性患病率差异无统计学意义。在年龄方面,青少年EDS的患病率最高,其次是老年人群和中青年人群。我国高质量流调资料相对缺乏,香港地区流调资料显示,6~18岁儿童青少年人群EDS发生率为29.2%。EDS患病率伴随着青春期的到来快速增长,由青春前期的19.8%,快速增长到青春期后期的47.2%[1]。美国一项调查显示,33%的成人报告EDS[2],通过访谈收集到青少年诉日间困倦者的比例高达41.5%,其中达到睡眠增多症诊断标准者为11.7%[11]。
多数研究以调查对象的主观判断作为评价依据。如果以“是否存在睡眠增多”提问,获得的EDS患病率最低,在0.3%~4.0%之间;以“日间频繁入睡或者出现睡眠发作”作为评价标准,中青年人群的患病率为5%~10%,老年人群的患病率为20%~30%;如果以“感觉到困倦”为标准,则EDS的患病率为10%~15%[10];EDS合并功能损害的患病率为15.6%[12]。
以神经系统疾病为代表的多种躯体疾病及精神障碍可出现EDS症状。在神经系统疾病中,癫痫、帕金森病、阿尔茨海默病和多发性硬化等可出现EDS。在精神障碍方面,有纵向研究显示,EDS与抑郁症之间有很强的相关性;在EDS儿童中父母报告的儿童焦虑、抑郁发生率增高,注意缺陷多动障碍等行为异常的发生率高于同龄人;有EDS的青少年成绩下降[13],焦虑、抑郁症状和自杀意念发生率增加[14, 15]。美国全国健康和营养调查(National health and nutrition examination survey,NHANES)前瞻性观察EDS对成人心血管疾病病死率的影响,平均随访8.3年后,EDS组心血管疾病死亡风险为无EDS组的2.85倍[16]。美国警方提供的资料显示,16.5%的致命交通事故和13.1%的导致住院的事故与司机的EDS有关[17],每年由于困倦驾驶发生的车祸平均为8.3万例,造成超过1 000人的死亡和7万多人受伤。可见EDS对个体、家庭和社会均造成巨大的负面影响。
EDS的本质是在应当维持清醒的时间段无法保持清醒和警觉,主要表现为过度困倦、无法抑制的睡眠、不经意的入睡、睡眠发作、频繁小睡,也包括睡眠需求过度、睡眠惯性、醉酒样睡眠,可伴有自动行为,以及疲劳、精力不足、认知功能损害等[5,13,18, 19]。
EDS的表现形式各异,一些患者在入睡前能够意识到困倦程度增加,而另一些患者在困意袭来时感到难以抗拒,以致在不经意间入睡,甚至毫无先兆地突然入睡,即睡眠发作,多持续10 min至数十分钟,也可短至数秒或长达数小时,每天数次到数十次不等[5,18]。一些患者存在睡眠需求过度(excessive need for sleep,ENS),24 h内需要10 h以上的睡眠,其中夜间睡眠至少9 h,其睡眠需求量的增加与日间清醒质量受损有关,但不能通过延长睡眠时间而完全缓解,醒后仍然缺乏体力和精力上的恢复感[5,18,20]。另一些患者的EDS可通过有意或无意的小睡得到暂时缓解,但之后很快又会重新出现,使得其一天内出现频繁小睡[5,18]。有些患者具有睡眠惯性(sleep inertia),又称醉酒样睡眠(sleep drunkenness),即由睡眠转换到完全清醒的时间延长,需使用多个闹钟或由他人摇晃、拉拽等方式促醒,此时易激惹、定向力减退、言语不连贯、反应迟缓、运动不协调等,严重者可在醒后持续数小时[5,13,18, 19, 20, 21]。此外,少数患者还可出现自动行为(automatic behavior),即在无意识或不完全受自身控制的情况下出现的行为[20],此时表面上看似处于清醒状态,但存在警觉性丧失[5],可表现为自动化的姿势、走动、言语或写出不连贯的语词等[22]。
低龄儿童的EDS可表现为夜间睡眠时间过长,或先前已消失的日间小睡重新出现。儿童的EDS可表现为注意力不集中、情绪不稳定、多动或学习成绩不佳等似乎与EDS表现不一致的症状[5,18]。
不同患者EDS的严重程度有所不同。EDS常在放松、安静、久坐、无聊、单调而无需主动参与的情境下出现,如看电视、阅读、听课、开会、乘车等。然而,EDS严重时也可在对注意力要求较高的活动中出现,甚至不分时间、地点和场合,如讲话、进食、行走、骑车等,这给患者的学习、工作、安全和生活带来很大困扰[5,18,22]。
此外,EDS的患者可能不会抱怨EDS本身,而是会抱怨其后果,如疲劳、精疲力竭、昏昏沉沉、缺乏主动性、记忆力减退、注意力不集中、在学习和工作中容易出错等,这也是EDS常伴随的表现[23]。然而,应注意思睡与疲劳的区别。疲劳可能伴随着EDS和睡眠增多,但它在本质上是一种与思睡不同的主诉[20]。疲劳指的是主观上缺乏体力或精力,启动或维持活动的能力降低,可伴随注意力、记忆力和情绪稳定性下降[9,13]。思睡多在静坐不动的情况下出现,而疲劳通常会妨碍参加主动的、需要努力的活动,或在此类活动后出现,在休息后往往是可逆的[19]。
对有EDS症状的患者,首先需详细采集病史、进行临床评估,初步判断EDS的特点及可能的病因,并结合初步判断进行相应的睡眠问卷评估和睡眠监测,依次排查以下可能导致EDS的原因:(1)睡眠卫生不良、睡眠不足、昼夜节律紊乱或失眠症;(2)躯体疾病、精神障碍或物质滥用;(3)睡眠呼吸障碍、睡眠相关运动障碍或异态睡眠;(4)中枢性嗜睡。具体诊断思路如下(图1):
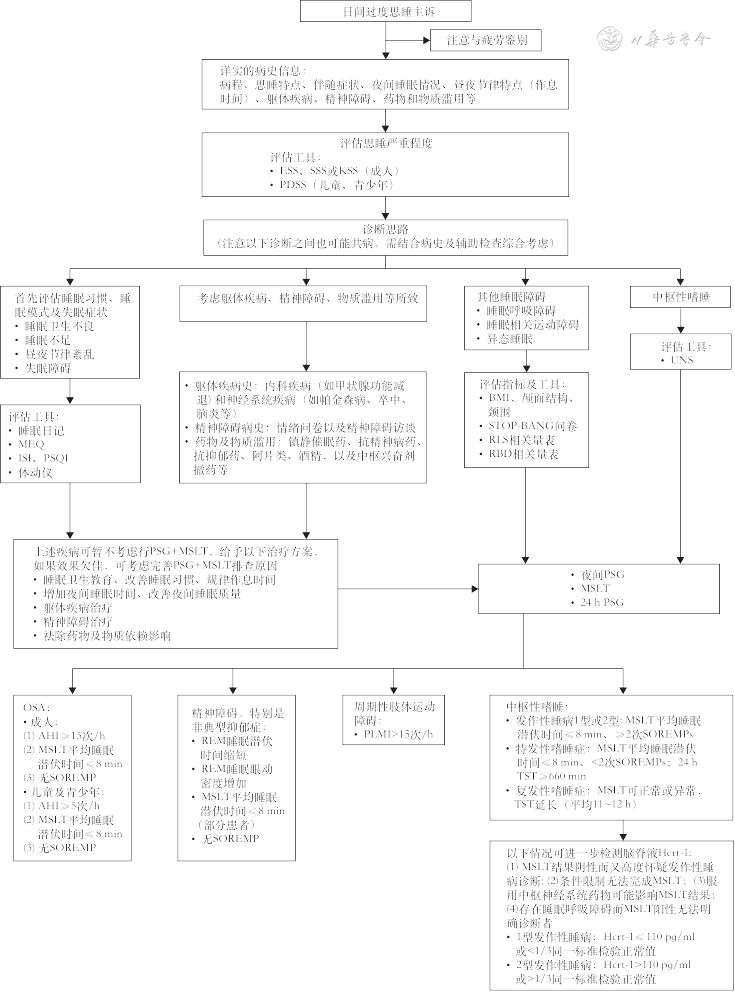

注:ESS为艾普沃斯嗜睡量表;SSS为斯坦福嗜睡量表;KSS为卡罗林斯卡嗜睡量表;PDSS为儿童日间嗜睡量表;MEQ为清晨型-夜晚型问卷;ISI为失眠严重程度指数;PSQI为匹兹堡睡眠质量指数;BMI为体质指数;RLS为不宁腿综合征;RBD为快速眼动睡眠行为障碍;UNS为乌兰林纳发作性睡病量表;PSG为多导睡眠监测;MSLT为多次小睡睡眠潜伏时间试验;OSA为阻塞性睡眠呼吸暂停;AHI为呼吸暂停低通气指数;SOREMP为睡眠起始快速眼动;REM为快速眼动;PLMI为周期性肢体运动指数;TST为总睡眠时间;Hcrt-1为下丘脑分泌素-1
1. 临床病史:详细询问临床病史,包括起病形式(急性、慢性)、思睡特点(发作性、持续性还是周期性发作、持续时间、发作频率、加重和缓解因素)、伴随症状(猝倒发作、睡瘫、睡眠幻觉)、夜间睡眠情况[睡眠质量、总睡眠时间、打鼾、周期性肢体运动、不宁腿症状、快速眼动(rapid eye movement,REM)睡眠行为异常等]、昼夜节律特点(作息时间)、躯体疾病(如甲状腺功能减退、脑炎、卒中、帕金森病、痴呆等)、精神障碍(如抑郁症、双相情感障碍等)、药物和物质滥用(如苯二氮䓬类药物、抗精神病药物、酒精、阿片类)及家族史等。
2. 临床评估:体质指数(body mass index,BMI)、颅面结构(如小下颌、扁桃体肿大、鼻中隔偏曲等),根据病史做相应内科查体、神经系统查体、精神检查及必要的辅助检查,排查内科、神经精神疾病、药物或物质滥用所致EDS。
3. 问卷评估及睡眠监测:(1)通过睡眠日记、清晨型-夜晚型问卷(morningness-eveningness questionnaire,MEQ)、失眠严重程度指数(insomnia severity index,ISI)、匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)、体动仪判断EDS是否为睡眠不足综合征、失眠症、昼夜节律紊乱所致;(2)通过STOP-BANG问卷、不宁腿综合征相关量表、REM睡眠行为障碍相关量表、多导睡眠监测(polysomnography,PSG)判断EDS是否与睡眠呼吸障碍、周期性肢体运动障碍或异态睡眠有关;(3)通过艾普沃斯嗜睡量表(Epworth sleepiness scale,ESS)、斯坦福嗜睡量表(Stanford sleepiness scale,SSS)、卡罗林斯卡嗜睡量表(Karolinska sleepiness scale,KSS)、儿童日间嗜睡量表(pediatric daytime sleepiness scale,PDSS)、乌兰林纳发作性睡病量表(Ullanlinna narcolepsy scale,UNS)、夜间PSG和日间多次小睡睡眠潜伏时间试验(multiple sleep latency test,MSLT)、24 h PSG,判断EDS是否为发作性睡病、特发性嗜睡症、复发性嗜睡症所致。
4. 实验室检查:脑脊液下丘脑分泌素-1检测可帮助鉴别1型和2型发作性睡病以及特发性嗜睡症[24]。
5. 共病鉴别及诊断:EDS也可能是两个及以上疾病共患所致,如发作性睡病可共患睡眠呼吸障碍、失眠症、精神障碍(如抑郁症)、周期性肢体运动障碍、REM睡眠行为障碍等,需结合临床病史、睡眠评估及检测结果综合判断。
EDS的病因很多,可能是单一因素,也可能是多种因素导致。常见的EDS病因有中枢性嗜睡(包括发作性睡病、特发性嗜睡症、复发性嗜睡症)、其他睡眠障碍(睡眠呼吸障碍、失眠症、睡眠不足综合征、昼夜节律相关睡眠-觉醒障碍等)、躯体疾病(内科疾病、神经系统疾病)、精神障碍和药物或物质所致嗜睡症[25]。
中枢性嗜睡是指中枢源性的思睡疾病,其EDS并不是由于夜间睡眠障碍或昼夜节律紊乱所致,包括发作性睡病、特发性嗜睡症和复发性嗜睡症。
1.发作性睡病(narcolepsy):发作性睡病是一种由于下丘脑食欲素神经元选择性缺失或功能障碍所导致的中枢性嗜睡疾病,主要临床表现包括EDS、猝倒发作、睡瘫、睡眠相关幻觉和夜间睡眠紊乱。目前根据是否存在猝倒发作或下丘脑分泌素-1水平降低,分为发作性睡病1型和2型,1型的患病率为0.02%~0.05%[26, 27, 28, 29],关于2型的流行病学报道较少。目前认为主要病因和病理生理学机制包括遗传因素、免疫学机制和环境因素等[5,30]。主要临床表现如下[31, 32]:(1)EDS:EDS是该疾病最常见的核心症状,主要表现为不可抑制地从清醒状态快速进入睡眠期,每次持续几分钟至几十分钟,小睡后可短暂缓解睡意。(2)猝倒发作(cataplexy):猝倒发作是下丘脑分泌素-1缺乏导致清醒状态下REM睡眠插入所致。主要表现为正常意识状态下,突然短暂的肌张力缺失,导致双下肢无力、倒地,或眼睑下垂、吐舌、头下垂等。猝倒发作常由情绪激动或进食等诱发。(3)睡瘫(sleep paralysis):睡瘫是清醒状态与REM睡眠转换异常所致,表现为刚入睡或醒来时,意识清醒,但无法自主活动或讲话,持续数秒到数分钟。(4)睡眠幻觉(hypnagogic hallucinations):睡眠幻觉是从觉醒向睡眠转换时的一种梦境样体验,多发生在入睡前,表现为幻听、幻视或幻触,伴随恐怖或不愉快的体验。(5)夜间睡眠紊乱(disrupted night sleep):主要表现有夜间频繁觉醒、睡眠质量差,可伴有睡眠呼吸障碍、REM睡眠行为障碍、周期性肢体运动障碍、不宁腿综合征等[33, 34, 35]。
发作性睡病因临床表现多样,患者可以不同症状为主诉就诊,导致误诊、漏诊、诊断延迟。目前发作性睡病的诊断是根据ICSD-3的诊断标准[5],其鉴别诊断也非常重要:(1)严重的EDS和睡眠发作也可发生在慢性睡眠剥夺或睡眠不足、睡眠呼吸障碍、倒班、心境障碍和特发性嗜睡症中;(2)猝倒发作易误诊为癫痫、晕厥或短暂性缺血发作等;(3)其他症状,如睡瘫或睡眠幻觉,需与癫痫、精神病性症状中的幻觉等进行鉴别。此外,也应注意排除继发因素导致的发作性睡病,如下丘脑肿瘤、自身免疫性脑炎等[5]。
2.特发性嗜睡症(idiopathic hypersomnia):特发性嗜睡症是一种慢性中枢性嗜睡疾病,患病率为0.02‰~0.05‰[36, 37, 38, 39],平均起病年龄为17岁[36],男女患病率近似,病理生理机制尚不清楚。主要表现为EDS、难以从夜间睡眠或日间小睡中清醒,日间难以维持觉醒和警觉性,出现无意识睡眠并干扰日间功能。与发作性睡病不同的是,特发性嗜睡症患者日间一般不出现睡眠发作,日间小睡时间更长且醒后不解乏,且夜间睡眠时间增加并不能改善EDS。
特发性嗜睡症根据ICSD-3进行诊断,需24 h总睡眠时间≥660 min[5],但该疾病为排除性诊断,应通过详细的临床病史和PSG、MSLT等检查排除睡眠不足综合征、心境障碍如抑郁症、镇静药物使用等其他可能导致EDS的因素。需要注意的是,通过MSLT的平均睡眠潜伏时间和睡眠起始快速眼动(sleep onset rapid eye movement period,SOREMP)鉴别诊断2型发作性睡病与特发性嗜睡症较不理想[40, 41]。近几年的研究发现,在夜间PSG及MSLT中,从清醒期或N1期直接进入R期是发作性睡病特异性较高的特征,有助于鉴别其他原因导致的EDS[42]。此外,人类白细胞抗原测定、下丘脑分泌素水平检测并非诊断特发性嗜睡症的必要检查,但可用于鉴别1型发作性睡病[43]。
3.复发性嗜睡症(recurrent hypersomnia):复发性嗜睡症又名克莱恩-莱文综合征(Kleine-Levin syndrome,KLS),以反复发作的思睡伴认知、精神和行为异常为基本特征。复发性嗜睡症患病率约为(1~5)/1 000 000[44, 45, 46],男性较女性多见[47, 48],中位发病年龄为16岁[47]。目前病因尚不明确,遗传、感染和免疫介导均有报道[47,49]。
复发性嗜睡症的病程分为发作期和发作间期,典型发作期持续时间中位数是10 d,可反复发作。在发作期可表现为思睡、认知障碍、情绪和行为改变等,而在发作间期恢复正常。发作期的具体表现如下[5,44,47, 48,50, 51]:(1)思睡:每天睡眠时间15~24 h不等,持续几天至几周,可被动唤醒或因进食、上厕所自发醒来,清醒期间常表现出烦躁、易怒甚至有攻击性。(2)认知障碍:大部分患者存在言语、阅读和记忆困难,以及时间、空间定向障碍。(3)现实感丧失:患者出现非真实感,对周围环境感知异常。(4)情感淡漠:对所有活动均缺乏动力。(5)其他症状:贪食、性欲亢进,情绪紊乱(如焦虑、抑郁、易激惹等),部分患者还有视、听幻觉和强迫行为。
根据ICSD-3,对存在两次以上反复发作的思睡,伴有认知功能、情绪及行为改变,且发作间期恢复正常的患者,需考虑复发性嗜睡症[5]。第三脑室肿瘤、脑炎、多发性硬化等神经系统疾病以及抑郁症、双相情感障碍等精神障碍也可出现类似的思睡症状,但其思睡很少突然出现或消失,发作间期也会存在部分症状;其他睡眠障碍如发作性睡病、阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)导致的思睡通常无反复性和周期性特点。
除中枢性嗜睡以外,凡是可改变睡眠连续性、质量、节律以及时长的睡眠问题均可引起EDS。其他常见的睡眠障碍列举如下。
1.睡眠呼吸障碍:EDS是大多数睡眠呼吸障碍患者就诊的主诉。这类疾病包括阻塞性、中枢性睡眠呼吸暂停(包括原发性、高海拔周期性呼吸所致、药物或物质所致)以及肥胖低通气综合征等,其中最常见的是OSA。BMI过高或肥胖(尤其是颈围增粗)、扁桃体肥大、咽喉气道狭窄[马兰帕蒂分级(Mallampati classification)第Ⅲ、Ⅳ级]是OSA的风险因素[52]。需注意,呼吸暂停低通气指数(apnea-hypopnea index,AHI)以及反映睡眠呼吸暂停严重程度的血氧饱和度与EDS的严重程度相关性很差,而睡眠呼吸暂停相关性觉醒引起的睡眠片段化被认为是导致EDS的重要原因[5]。
2.失眠症:EDS在失眠患者中并不少见。然而,与其他EDS患者相反,失眠症患者很少或很难在无意中自发入睡。此外,患者常伴有疲劳的主诉,应注意与思睡相区分。疲劳主要表现为缺乏能量和精力做事,以致活动量减少。这种症状很容易与主观思睡以及无意识的睡眠发作相区别。
PSG不是失眠的常规检查手段。因此,如果怀疑EDS是由失眠症引起,不会首先考虑进行PSG。EDS在失眠症缓解后可得到改善。如果患者存在失眠合并EDS,尤其怀疑发作性睡病时,需要进行PSG和MSLT[5]。
3.睡眠不足综合征:睡眠不足综合征是由于个体持续无法获得维持正常警觉性和清醒水平所需的睡眠量,而不是任何潜在的躯体疾病、情绪或环境原因造成的睡眠障碍。换句话说,它是当人们将睡眠时间用于做其他事情,而没有足够时间休息时发生的睡眠不足。患者几乎每天都有不可抗拒的睡眠需求或在白天陷入睡眠。患者通常在早晨很难自然醒来,需要通过闹钟或被他人叫醒等措施起床。而在周末或假期,患者不需要闹钟或被他人叫醒时,一般会睡得更久,具有明显的节假日睡眠补偿现象[53]。
睡眠不足综合征可影响所有年龄和性别的人群。在青少年中,睡眠不足综合征是引起EDS最常见的原因。根据睡眠缺失的持续时间和程度,除EDS外,可能会表现出易怒、注意力不集中、警觉性降低、心烦意乱、积极性降低、精神不振、疲劳、不安等症状。对睡眠习惯和模式的详细了解有助于识别睡眠不足[5]。需要注意的是,对于一些长睡眠者来说,将睡眠时间延长到9 h以上,往往可明显提高日间功能,改善思睡症状。
4.昼夜节律相关睡眠-觉醒障碍:昼夜节律是对身体24 h“内部时钟”的称呼。这个内部时钟控制着身体的睡眠-觉醒周期。当身体内部时钟与外在环境不协调时,则出现一系列睡眠-觉醒紊乱的症状,如失眠症状、EDS,或两者兼有[54]。
根据不同昼夜节律相关睡眠-觉醒障碍的分类,EDS出现的时间可能不同[5,55]。睡眠-觉醒时相延迟患者的“内部时钟”延迟,可能出现睡眠时间不足以及过度的睡眠惯性,因此EDS可能非常突出。睡眠-觉醒时相提前的患者主要表现为睡眠维持困难及早醒,EDS一般出现在傍晚时分。无规律性昼夜节律相关睡眠-觉醒障碍的患者在24 h内出现不规则的睡眠和觉醒,其特征是在预定的睡眠时间内(通常在晚上)出现失眠症状,而在白天出现EDS(打盹),或两者兼而有之。非24 h昼夜节律相关睡眠-觉醒障碍的患者由于内源性昼夜节律与外部24 h环境不一致,随着睡眠阶段的持续漂移,使最大的内源性睡眠倾向可能出现在白天,此时患者会在白天难以保持清醒。倒班与时差相关睡眠障碍也常常出现上述失眠以及EDS症状,特别是工作或所在时区要求清醒的时间与通常或原有的睡眠时间重叠时。因此,详细筛查患者的睡眠习惯及倾向有助于识别上述昼夜节律相关睡眠-觉醒障碍[5]。
5.其他不常见的情况:除上述睡眠障碍外,睡眠相关运动障碍也可导致EDS或疲劳,这是诊断此类睡眠障碍的先决条件之一。这些睡眠相关运动障碍包括不宁腿综合征、周期性肢体运动障碍、交替下肢肌肉活动等。其他影响夜间睡眠质量的睡眠障碍,如睡眠相关性胃食管反流、睡眠相关癫痫、异态睡眠(睡行症、睡惊症、REM睡眠行为障碍)等也可伴有EDS[56, 57]。这些睡眠障碍导致的EDS特异性较差,在排除其他引起EDS的原因后方可考虑[5]。
EDS是许多精神障碍的症状之一。相关的精神障碍包括心境障碍、转换障碍或躯体症状障碍,并且较少见于其他精神障碍,如分裂情感障碍、适应障碍或人格障碍[5]。在重性抑郁症患者中,EDS的发病率可高达50%,同时,EDS可影响50%以上的季节性情感障碍患者[58]。
此类患者除EDS外,通常表现出夜间睡眠过多,因此很难与精神障碍合并特发性嗜睡症鉴别。然而,患者常常感到睡眠质量差,睡眠后无精力恢复感。
精神障碍患者可出现睡眠潜伏时间延长、入睡后清醒时间增加、睡眠效率降低。在未经治疗的抑郁症患者中,REM睡眠潜伏时间可能会缩短,但MSLT的睡眠潜伏时间通常在正常范围内,这一结果与主诉的EDS形成鲜明对比[5]。
很多内科疾病或神经系统疾病等躯体疾病可引起EDS,如果该躯体疾病是导致EDS的直接原因,可确定为EDS的唯一诊断。常见的导致EDS的躯体疾病包括:全身性疾病,如肥胖、慢性感染、风湿病、癌症、中毒[5,59, 60, 61, 62, 63, 64, 65, 66];代谢性脑病,如肝性脑病、肾性脑病[67, 68];内分泌疾病,如甲状腺功能减退、垂体瘤[69, 70];神经系统疾病,如脑炎(如病毒性脑炎、自身免疫性脑炎)、脑外伤、卒中、脑肿瘤(如下丘脑肿瘤、副肿瘤综合征)、神经变性疾病(帕金森病、痴呆)[5,66,71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82];遗传性疾病等[83, 84, 85, 86, 87, 88, 89, 90, 91]。
通常会综合临床病史、体格检查、量表问卷评估以及实验室检查等多个维度来评估EDS的严重程度,详见本文诊断思路部分。以下是评估思睡常用的主观评估工具、客观评估工具以及生化-基因检测等。
1. ESS:常用于评估日间思睡的严重程度。问卷评估近期在8种久坐不动的情况下打瞌睡的频率:静坐阅读、看电视、在公共场合坐着不动、乘坐汽车持续1 h、午后躺下休息、坐着与人交谈、午餐(不饮酒)后静坐、堵车时停下数分钟。将每种情况评为0~3分(0=不会打瞌睡,3=打瞌睡可能性高)。ESS得分≥11分视为过度思睡,≥16分提示有严重思睡。ESS适用于成年人,简便易操作,能够可靠地评估主观思睡,其得分与客观评估指标中度相关[97]。
2. SSS:适合测试受试者当下的主观倦意。受试者在以下7项陈述中选出最符合自己思睡水平的1项:1=感觉清醒,有活力;2=身体状况、思维能力良好,但不是最佳状态,能够集中注意力;3=放松、清醒,反应能力不是最佳;4=多少有些不清醒,情绪不高;5=头脑不清醒,有点想睡,思维变慢;6=困倦,努力坚持不睡着,希望躺着;7=无法持续保持清醒,很快可以入睡,出现类似做梦的思维活动。如果受试者在应该警觉时选择第4~7项,则可能有过度思睡。SSS的优点是可在治疗的不同阶段进行纵向比较,与急性睡眠剥夺的相关性良好[98]。
3. KSS:是用于测量当前个体主观感知的思睡和警觉性问卷,属于评估主观思睡和警觉程度的指标,其优点在于操作简单,并可反复多次进行。该量表需要被试对包含10个选项的题目作答,被试根据自己当前的清醒和思睡状态选择相应的选项,得到1~10之间的评分,分数越高代表清醒程度越低、思睡程度越重[99]。
4. PDSS:为11~15岁人群设计,用于评估青少年儿童日常学习生活中思睡的主观感受[100]。问卷共包括8个条目,选项为0(从不)~4(总是)五级评分。分数越高,提示日间思睡越明显。在使用18/19分作为界值时,筛查发作性睡病的灵敏度和特异度较高。
5. UNS:用于发作性睡病的思睡、猝倒症状和夜间睡眠潜伏时间的评估。该自评问卷共包括11个条目,选项根据症状发生的频率为0~4分五级评分。在发作性睡病的筛查中,推荐以UNS总分≥14分为界值,具有较高的灵敏度和特异度[101]。尤其是对于1型发作性睡病,<9分有助于排除此诊断[102]。
1. PSG:有助于评估夜间睡眠状况、发现夜间睡眠伴随的事件,对于病情的全面评估具有重要价值。因此,当怀疑有OSA、周期性肢体运动障碍、发作性睡病、其他中枢性嗜睡或睡眠期癫痫发作,或根据病史和体格检查未能明确思睡原因时,推荐使用PSG评估。在具有EDS表现的多种不同睡眠障碍中,PSG具有以下不同特征:OSA表现为阻塞性呼吸暂停、低通气和呼吸努力相关觉醒的次数增加;中枢性睡眠呼吸暂停表现为中枢性呼吸暂停、低通气和觉醒的次数增加;发作性睡病可能表现为入睡潜伏期缩短、N1期睡眠增加、N3期睡眠减少等睡眠结构的改变,并可能出现SOREMP、入睡后觉醒次数增加、睡眠效率下降、觉醒指数增加、R期眼动指数升高、REM睡眠期肌电失弛缓并出现梦境演绎行为等;周期性肢体运动障碍表现为刻板性腿部抽动,可能伴或不伴觉醒次数增加[31]。
2. MSLT:目前被认为是可客观量化思睡的一种标准测量方法,是发作性睡病的重要诊断依据,也有助于评估特发性嗜睡症。因此,进行MSLT的两个主要指征为疑似发作性睡病或特发性嗜睡症,而不适合作为疑似OSA、失眠症或昼夜节律相关睡眠-觉醒障碍等其他可导致思睡的睡眠障碍以及神经系统疾病等躯体疾病的常规评估。MSLT的主要测量指标为平均睡眠潜伏时间和SOREMP次数。平均睡眠潜伏时间≤8 min一般认为是存在思睡的客观证据,若同时存在2次或以上SOREMPs则支持诊断发作性睡病,其中1次SOREMP可由前夜PSG中的SOREMP替代;若仅有平均睡眠潜伏时间≤8 min则支持特发性嗜睡症的诊断。
3. 清醒维持测验(maintenance of wakefulness test,MWT):用于评估受试者在日间安静环境中保持清醒的能力。不同于MSLT评估入睡的倾向,该检查评估保持清醒的能力,因此不能互相取代。MWT的主要测量指标为平均睡眠潜伏时间,一般认为平均睡眠潜伏时间≤8 min为异常。在4次检测中都至少保持40 min清醒,是受试者可以保持清醒的客观证据[103]。根据美国睡眠医学会(American Academy of Sleep Medicine,AASM)推荐,当发作性睡病、OSA、倒班工作等疾病或状态可能影响患者的日间觉醒能力、对患者或公众构成潜在威胁时,可通过MWT评估其日间保持清醒的能力,避免从事危险性职业,并且可以在研究中作为药物改善觉醒能力的疗效或不良反应的评价指标[103]。
4. 体动仪:通常指置入加速计的类似手表的可穿戴设备,可有效地客观测量数日至数周内的睡眠参数和平均运动时长,用于评估睡眠-觉醒周期[104]。在思睡患者的评估中,体动仪可用于证实EDS的严重程度以及排除睡眠不足,尤其是在MSLT检查前。此外,由于可在患者的家庭环境中进行测量,与单夜PSG相比,体动仪的结果具有较高的外部睡眠环境真实性等优势。但是,当需要脑电图来记录睡眠结构、睡眠分期或睡眠期间的异常运动时,或怀疑存在睡眠呼吸障碍时,体动仪不能替代PSG。
5. 其他客观评估工具:牛津睡眠抵抗测验(Oxford sleep resistance test,OSLER test)是MWT的简化版,也是间接量化EDS的客观评估工具[105];精神行为警觉测验(psychomotor vigilance task,PVT)是基于对视觉刺激的反应来测量警觉性[106];另外,驾车试验也常用于警觉性评估[107]。
1. 下丘脑分泌素-1(hypocretin-1):对于具有EDS主诉、临床高度怀疑发作性睡病的患者,脑脊液下丘脑分泌素-1(也称食欲素-A)的检测有助于明确诊断,尤其是当MSLT检查1次或多次结果为阴性、MSLT结果阴性却伴有典型猝倒发作、由于个人原因或研究条件限制无法完成MSLT、因服用药物或共患疾病可能干扰MSLT结果时[108, 109]。脑脊液中下丘脑分泌素-1浓度≤110 pg/ml或小于以同一标准检验正常者平均值的1/3可替代MSLT作为1型发作性睡病的诊断标准。
2. 基因检测:并不常规用于EDS患者的评估。由于人类白细胞抗原(human leukocyte antigen,HLA)DQB1*06∶02、DQB1*03∶01等位基因与1型发作性睡病密切相关,该检测在伴有猝倒、怀疑发作性睡病患者的鉴别诊断中具有一定意义。研究发现,超过90%的1型发作性睡病患者携带DQB1*06∶02,因此,对于非典型猝倒患者,若无DQB1*06∶02,则支持排除1型发作性睡病。但很多健康人也携带该等位基因,因此该指标特异性并不高[110]。
3. 药物或物质浓度检测:对于药物或物质所致EDS,可通过检测血液中相关药物或物质的浓度协助诊断。
分析病因是EDS治疗的首要任务,对于存在明确病因的EDS患者(如继发于中枢神经系统疾病、应用镇静药物等),应积极治疗原发病、处理相关因素。EDS的治疗包括药物治疗和非药物治疗。
非药物治疗包括生活方式干预、睡眠卫生宣教、行为调整等,几乎适用于所有EDS患者,并且是EDS治疗的基本措施。对于睡眠不足和昼夜节律紊乱相关的EDS,非药物治疗显得尤为重要。值得注意的是,非药物治疗对于EDS的效果还缺乏充分的随机对照试验来验证。
1. 生活方式干预(Ⅲ B):生活方式干预首先是获得患者认同,并改变其生活方式和不良睡眠卫生习惯。具体措施包括调整睡眠时间、创造有利的睡眠环境、减少在床上进行与睡眠不相关的活动(如看手机)、睡前避免干扰睡眠的物质(如酒精、咖啡)的摄入[111, 112, 113, 114]。规律且充足的夜间睡眠、日间规律的体育锻炼、短暂的小睡(20 min左右),有助于促进夜间睡眠和提高日间的警觉性[115, 116, 117, 118]。对于睡眠呼吸障碍患者,生活方式干预主要为戒酒、减重、体育锻炼,鼓励打鼾患者采取侧卧位睡眠。
2. 调整入睡和起床时间(Ⅲ B):对于昼夜节律延迟或前移的患者,可分别逐步提前或推迟入睡和起床时间,以达到社会和职业要求的作息时间,纠正不良睡眠卫生习惯。对于难治性患者,也可以使用时间疗法,即对于昼夜节律延迟的患者,逐步推迟入睡和起床时间;对于昼夜节律前移的患者,逐步提前入睡和起床时间,最终达到期望的作息节律[119]。
3. 光照疗法(Ⅲ B):晨起规律的光疗(约1 000 lux,每日持续≥30 min)可使昼夜节律提前,可作为昼夜节律延迟患者的一种尝试手段[120]。此外,昼夜节律延迟患者应避免夜间光照[121, 122]。傍晚和夜间早期光疗(如2 500~10 000 lux,持续1~3 h)是针对昼夜节律前移患者的主要光照治疗方法[123, 124]。倒班者为了维持夜间的清醒状态,可适当提高夜间工作的光照强度[125, 126]。
4. OSA所致EDS的治疗:无创正压通气是睡眠呼吸障碍患者治疗的首选[127, 128](Ⅰ A),根据患者的特点,选择合适的模式,并评估患者对无创正压通气的依从性。对于拒绝或不依从无创正压通气的患者,可进行口腔矫治器治疗[129, 130](Ⅰ A)。拒绝口腔矫治器或口腔矫治器疗效差的患者,可进行上气道手术[131, 132](Ⅰ A)。不耐受无创正压通气且无气道塌陷的患者可进行舌下神经刺激术[133](Ⅱ A)。
5. 失眠所致EDS的治疗:针对失眠症的治疗,如认知行为疗法(Ⅰ A)、经颅电刺激(Ⅱ A)、经颅磁刺激(Ⅱ A)可改善睡眠质量,缓解失眠引起的EDS[134]。
1. 促觉醒药:促觉醒药首先应用于中枢性嗜睡患者。临床上应用较多的主要为1型发作性睡病的治疗,某些促觉醒药还可以控制猝倒发作(如替洛利生、γ-羟丁酸钠)。目前可用于治疗EDS的促觉醒药及相关药物的用量、适应证及不良反应等注意事项见表3。特别需要强调的是,综合目前的循证医学证据、药物不良反应及成瘾倾向等因素,在1型发作性睡病的治疗中[13,32],首选药物是替洛利生(pitolisant)、莫达非尼(modafinil)、γ-羟丁酸钠(gamma-hydroxybutyrate,sodium oxybate),其他药物包括阿莫达非尼(armodafinil)、哌甲酯(methylphenidate)缓释片、索林非妥(solriamfetol)、马吲哚(mazindol)等[31](Ⅱ B)。如单药使用不能很好地控制患者的EDS,可以考虑联合用药。常用的联合用药策略包括:γ-羟丁酸钠+莫达非尼/阿莫达非尼/替洛利生,哌甲酯+γ-羟丁酸钠,莫达非尼/哌甲酯+替洛利生[135](Ⅱ B)。睡眠呼吸障碍患者如经有效无创正压通气治疗后EDS仍未缓解,可以使用替洛利生、莫达非尼/阿莫达非尼、索林非妥[13](Ⅱ B)。倒班人员必要时可以使用莫达非尼/阿莫达非尼保持夜间警觉[126](Ⅱ B)。

可用于治疗日间过度思睡的神经兴奋剂及相关药物
可用于治疗日间过度思睡的神经兴奋剂及相关药物
| 药物名称 | 推荐等级 | 剂量 | 适应证 | 注意事项 |
|---|---|---|---|---|
| 替洛利生 | Ⅱ A | 18~36 mg/d 起始剂量9 mg/d | 成人和儿童发作性睡病、特发性嗜睡症、OSA患者的EDS | 不良反应包括失眠、头痛、恶心、焦虑、易激惹、头晕、抑郁、震颤、睡眠障碍、疲乏、呕吐、眩晕、消化不良 |
| 莫达非尼 | Ⅱ A | 200~400 mg/d 顿服或分两次服用 | 成人和儿童发作性睡病、特发性嗜睡症、α-突触核蛋白病/脑外伤/神经系统遗传疾病/脑肿瘤/中枢神经系统感染相关的EDS | 不良反应包括失眠、恶心、腹泻、头痛、口干;存在药物依赖和成瘾风险,孕妇使用有导致胎儿先天畸形的风险,降低口服避孕药的效果;个别病例报告<17岁的患者使用会出现Stevens-Johnson综合征、精神错乱(FDA黑框警告) |
| γ-羟丁酸钠 | Ⅱ A | 6~9 g每晚 每2~4小时为间隔服用 | 成人和儿童发作性睡病、特发性嗜睡症、α-突触核蛋白病相关的EDS | 不良反应包括恶心、眩晕、夜间遗尿、头痛、胸部不适、睡眠紊乱、睡眠呼吸障碍;可出现中枢抑制和呼吸抑制作用(FDA黑框警告),与其他中枢抑制性药物或物质合用(如酒精、镇静药物)会导致意识障碍、呼吸抑制甚至死亡 |
| 索林非妥 | Ⅱ A | 150 mg/d 起始剂量75 mg/d | 成人发作性睡病 | 不良反应包括失眠、头痛、恶心、胸部不适、食欲下降;存在药物依赖和成瘾风险;心脏病、未控制的高血压患者慎用;不可与单胺氧化酶抑制剂合用 |
| 阿莫达非尼 | Ⅱ B | 150~250 mg/d 晨起顿服或分两次服用 | 成人发作性睡病、α-突触核蛋白病/脑外伤相关的EDS | 不良反应包括恶心、上呼吸道感染、头痛、眩晕、鼻窦炎、困倦;存在药物依赖和成瘾风险,孕妇使用有导致胎儿先天畸形的风险,降低口服避孕药的效果 |
| 右旋安非他命 | Ⅱ B | ≤60 mg/d | 成人发作性睡病 | 存在药物依赖和成瘾风险(FDA黑框警告);可出现QT间期延长 |
| 哌甲酯 | Ⅱ B | ≤100 mg/d | 成人发作性睡病、特发性嗜睡症 | 不良反应包括口干、盗汗、头痛、食欲不振、胃部不适;对于存在药物依赖和成瘾风险的患者应谨慎使用(FDA黑框警告);心脏病、未控制的高血压患者慎用 |
| 克拉霉素 | Ⅱ B | 500~1 000 mg/d | 特发性嗜睡症 | 具有中枢性抗GABA作用,增加心脏不良事件的发生风险(心脏病患者慎用);不推荐孕妇使用;防止多重耐药菌感染 |
| 锂剂 | Ⅱ B | 300 mg,3次/d,维持血药浓度0.8~1.2 mEq/ml | 成人复发性嗜睡症 | 监测血药浓度,防止中毒;肾病、甲状腺疾病、甲状旁腺疾病患者慎用 |
注:OSA为阻塞性睡眠呼吸暂停;EDS为日间过度思睡;FDA为美国食品药品监督管理局;GABA为γ-氨基丁酸
2. 褪黑素及其受体激动剂:褪黑素主要用于昼夜节律紊乱导致EDS的患者。短期使用褪黑素(习惯睡眠开始前5~7 h或目标入睡时间前2~3 h给予0.3~5.0 mg)可以改善入睡时间,调节生理性昼夜节律,给药时间越早,时相前移程度越明显[119]。然而,健康成人使用大剂量褪黑素会出现头痛、思睡、低血压、高血压、胃肠不适及斑秃等不良反应,同时长期使用会抑制内源性褪黑素的分泌。大剂量使用褪黑素(≥10 mg/d)可抑制性激素分泌,因此在儿童、青少年中应慎用[136]。时差障碍的患者,向东旅行时,可在目的地时间每晚入睡前服用褪黑素0.5~3.0 mg,直到适应目的地昼夜节律;向西旅行时,可在后半夜服用褪黑素0.5 mg。对于褪黑素治疗无效的患者,可考虑使用褪黑素受体激动剂他司美琼或雷美替胺,但不能改变时差障碍患者的昼夜节律[137, 138](Ⅱ B)。
3. 镇静催眠药物:此类药物主要用于昼夜节律紊乱导致EDS患者的助眠。对于已形成良好睡眠卫生习惯但白天仍难以按时入睡的倒班人员,可适量使用短效苯二氮䓬类、非苯二氮䓬类或食欲素受体拮抗剂[125],但这并不能缓解思睡,使夜班工作时保持警觉。镇静催眠类药物有助于缓解时差所致的失眠症状,但不推荐长期使用。
4. 其他药物:针对不宁腿综合征或周期性肢体运动障碍的治疗药物主要目的在于缓解症状,改善夜间睡眠,解决EDS。目前常用的治疗不宁腿综合征的药物包括多巴胺受体激动剂、α-2-δ钙通道配体(加巴喷丁、普瑞巴林)、阿片类等[139]。周期性肢体运动障碍患者可试用多巴胺受体激动剂治疗,如存在禁忌证,可尝试α-2-δ钙通道配体[139]。
本共识由编委会根据国内外最新的研究进展,经过反复讨论最终成稿,以指导EDS的临床诊疗实践。本共识仅反映了截至目前的文献证据和专家意见,希望本共识能够引起对EDS的广泛关注,日后待更多、更充分的循证医学依据纳入后,中国睡眠研究会还会对其进行进一步的修订和更新,并希望在此基础上形成针对EDS的规范性的诊疗指南。
本共识编写委员会专家名单
执笔人(按姓氏汉语拼音排序):范滕滕(北京大学第六医院睡眠医学中心);刘帅[南方医科大学南方医院精神心理科(睡眠医学中心)];刘亚平(香港中文大学医学院精神科学系);肖伏龙(北京大学人民医院全科医学科);于欢(复旦大学附属华山医院神经内科);周俊英(四川大学华西医院睡眠医学中心);张斌[南方医科大学南方医院精神心理科(睡眠医学中心)]
讨论专家(按姓氏汉语拼音排序):陈贵海(安徽医科大学附属巢湖医院睡眠障碍科);邓丽影(南昌大学第二附属医院神经内科);范滕滕(北京大学第六医院睡眠医学中心);冯媛[南方医科大学南方医院精神心理科(睡眠医学中心)];高东(陆军军医大学大坪医院睡眠心理中心);高雪梅(北京大学口腔医学院睡眠呼吸障碍诊疗中心);顾平(河北医科大学第一医院神经内科);韩芳(北京大学人民医院呼吸睡眠医学科);胡克(武汉大学人民医院呼吸与危重症医学科);胡志安(陆军军医大学基础医学院生理学教研室);黄志力(复旦大学基础医学院药理学系);贾福军(广东省人民医院,广东省精神卫生中心);李庆云(上海交通大学医学院附属瑞金医院呼吸内科);李善群(复旦大学附属中山医院呼吸内科);李延忠(山东大学齐鲁医院耳鼻咽喉科);李韵(汕头大学医学院睡眠医学中心);李占江(首都医科大学附属北京安定医院临床心理中心);刘帅[南方医科大学南方医院精神心理科(睡眠医学中心)];刘亚平(香港中文大学医学院精神科学系);吕云辉(云南省第一人民医院睡眠医学中心);潘集阳(暨南大学附属第一医院精神医学科);时杰(北京大学中国药物依赖性研究所);宿长军(空军军医大学唐都医院神经内科);孙洪强(北京大学第六医院睡眠医学中心);唐吉友(山东第一医科大学第一附属医院神经内科);唐向东(四川大学华西医院睡眠医学中心);王菡侨(河北医科大学第三医院呼吸睡眠科);王涛(华中科技大学协和医院神经内科);王玉平(首都医科大学宣武医院神经内科);王赞(吉林大学第一医院神经内科);魏世超(福建省立医院睡眠医学中心);吴惠涓(海军军医大学第二附属医院神经内科);肖伏龙(北京大学人民医院全科医学科);谢宇平(甘肃省人民医院,甘肃省睡眠医学中心);许志飞(首都医科大学附属北京儿童医院呼吸科);薛蓉(天津医科大学总医院神经内科);叶京英(清华大学附属北京清华长庚医院耳鼻咽喉头颈外科);殷善开(上海交通大学附属第六人民医院耳鼻咽喉头颈外科);于欢(复旦大学附属华山医院神经内科);詹淑琴(首都医科大学宣武医院神经内科);张斌[南方医科大学南方医院精神心理科(睡眠医学中心)];张红菊(河南省人民医院神经内科);张熙(解放军总医院神经内科);赵忠新(海军军医大学第二附属医院神经内科);周俊英(四川大学华西医院睡眠医学中心);朱雨岚(哈尔滨医科大学附属第二医院神经内科)
中国睡眠研究会. 日间过度思睡临床诊断和治疗专家共识[J]. 中华医学杂志, 2023, 103(15): 1103-1118. DOI: 10.3760/cma.j.cn112137-20221228-02712.
所有作者均声明不存在利益冲突



























