
牙周炎是常见的口腔感染性疾病之一,可造成牙周支持组织的破坏,甚至牙齿的松动和脱落。控制感染,消除炎症,恢复牙周组织的生理形态,满足功能和美学需求是牙周治疗的主要目标。当牙周炎发展到较严重的阶段后,需要通过手术治疗对软硬组织进行处理,才能获得良好的效果。自1990年Myers研制了第一台口腔医学专用Nd:YAG激光器以来,历经30余年的临床和基础研究结果表明,激光在辅助牙周手术治疗方面拥有巨大的潜力。本文总结了激光辅助牙周手术治疗的原理和操作常规,以期为临床诊疗提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,2023年从第1期至第8期共刊发11篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
手术治疗是牙周病治疗的重要组成部分,主要包括切除性手术、重建性手术、再生性手术和美容性手术。除了阻止牙周疾病进展,牙周手术治疗的目标还涉及通过引导性组织再生术(guided tissue regeneration,GTR)和膜龈手术等一系列治疗改善因炎症破坏造成的软硬组织缺损,从而促使牙周组织的再生和修复,恢复生理形态和功能,并满足美观需求。其中牙周软硬组织的修整是牙周手术治疗中的关键环节。传统牙周手术通常采用手术刀片、刮治器、骨凿和骨锉进行牙周软硬组织的修整,在实现治疗效果的同时,往往伴有显著的术中出血和术后肿胀,激光的出现为牙周手术提供了新的选择。
激光是受激辐射的光放大,放大过程是通过激光器的核心激光腔来实现的。激光腔主要由增益介质、泵浦源和光学谐振腔构成。激光设备通常根据增益介质的材料命名,例如以固态半导体为增益介质的半导体激光。与普通光线相比,激光具有良好的单色性和相干性,可使其产生特定形式的聚焦,以实现治疗的目的。激光器产生的光波包含了从波长1×10-12 m的γ射线至波长数千米的无线电波。口腔激光器波长集中于可见光波段和不可见红外光波段(500~10 600 nm)。早在1964年,Goldman等[1]就报道了激光对健康牙齿、龋齿和其他口腔组织的作用,随后耳鼻咽喉科医师、口腔颌面外科医师和牙周科医师开始使用医用激光在口腔内开展多种软组织外科应用。目前,激光在口腔疾病治疗中的应用越来越普遍,与传统牙周手术治疗相比,激光辅助牙周手术治疗具有明显优势,例如易消融小体积组织、止血效果良好及治疗后创口愈合快等。本文将结合近年来激光在牙周手术治疗中应用的研究进展,阐述激光辅助牙周手术治疗的原理和操作常规,以期为激光在牙周手术治疗中的应用提供参考。
根据牙周组织的光学特性,激光与组织可发生4种不同的相互作用,即吸收(absorption)、反射(reflection)、透射(transmission)和散射(scattering)。透射与散射可穿达组织深层造成损伤,而可控的吸收作用更安全,因此,吸收是激光对组织发挥治疗作用的主要方式。组织对激光的吸收主要取决于激光的波长和靶组织的类型。不同类型的激光在不同参数下可产生不同的组织效应,主要包括光热效应、光化效应、光生物效应、光压效应及电磁场效应[2]。其中,光热效应是激光辅助牙周手术治疗的主要效应。在生物组织中,激光能量被表面组织吸收,吸收的光能转化为热量并产生光热效应,进而实现对组织的切开或切除、消融或汽化以及止血或凝固等作用[3]。光热效应的形式与组织的温度变化密切相关。当目标组织温度在60~100 ℃时,蛋白质发生变性;目标组织温度达100~150 ℃时,导致水分蒸发汽化;目标组织温度升高至200 ℃以上时,可引起组织脱水燃烧,形成终末产物碳,通过热传导进一步引起周围组织的热损伤,这一过程被称为“组织炭化”。激光对组织光热效应的具体作用形式受光斑尺寸、激光能量和作用时间等因素的影响。通常聚焦的小光斑激光束进行切开或切除手术,大光斑激光束产生组织表面消融,离焦的激光束会产生止血或凝固作用。低能量水平的激光则可发挥光生物效应,缓解术后疼痛肿胀,促进组织再生。
影响组织吸收能量的因素主要包括激光的参数及组织的光学特性。激光参数包括发射波长、功率、波形(连续或脉冲)、脉冲持续时间、能量/脉冲、能量密度、暴露持续时间、脉冲峰值功率以及能量输送尖端到目标表面的角度。组织的光学特性在很大程度上决定了与特定激光波长的相互作用。口腔组织的主要成分为水、色素、血液和矿物质,对不同波长的激光具有不同的吸收系数。组织的激光能量吸收取决于激光波长。在中间红外光谱中发射能量的激光,例如CO2(波长10 600 nm)激光和铒激光(Er:YAG,波长2 940 nm;Er,Cr:YSGG波长2 740 nm)主要被水和羟基磷灰石吸收,作用于组织表面,不穿透或散射,被称为表面吸收型激光[4]。CO2激光对止血和杀菌作用相关的软组织手术有效,但其能量易被牙体硬组织和骨组织和吸收,产生热损伤;铒激光可诱导矿化组织中水的光热蒸发,导致目标组织的薄层消融,这个过程安全且无热损伤。1997年,美国食品药品监督管理局批准铒激光应用于处理牙体硬组织。但铒激光不易被血红素吸收,止血效果不佳。在近红外光谱中发射的激光器,例如Nd:YAG(波长1 064 nm)激光和半导体激光器(波长635~980 nm)能穿透并深入组织达数毫米,被大分子和色素吸收,主要产生凝固和炭化作用,被称为深度穿透型激光。光生物调节(photobiomodulation,PBM)也称低能量激光治疗(low-level laser therapy),是指低功率强度的激光作用于组织时,不造成生物组织的不可逆损伤,同时可以产生生物刺激效应,达到治疗目的。PBM引起的组织温度升高不超过0.5 ℃,所采用激光的输出功率通常低于500 mW,输出能量密度为1~4 J/cm2。PBM主要的生理效应包括消炎、镇痛及促进组织愈合,PBM照射后能通过抑制炎症介质的产生发挥抗炎作用。PBM可能导致血管扩张和局部血液灌流增加,使更多的免疫细胞向受损部位迁移,从而促进组织修复[5]。此外,PBM还有利于成纤维细胞的增殖和成熟以及向肌成纤维细胞的转化,并且能减少成纤维细胞前列腺素E2的生成,同时增加成纤维细胞生长因子的分泌[6]。
1. 切除性手术:牙周切除性手术主要应用于去除增生的牙龈组织和修整牙龈外形,目前口腔治疗中常用的Nd:YAG激光、半导体激光、铒激光和CO2激光均可用于牙周切除性手术。使用激光进行牙龈切除和成形术时,激光照射可以封闭术区血管和淋巴管,进而减少术后水肿。与传统手术使用刀片切除牙龈组织相比,激光切除后牙龈创口收缩和瘢痕形成减少。电外科手术主要通过热消融去除牙龈组织,术后的坏死区域可达500~1 500 μm,而激光能更加精准地切除牙龈组织,并降低术后坏死区的范围。Nd:YAG激光和半导体激光软组织穿透深度约500 μm,具有较高水吸收率的铒激光和CO2激光仅在组织表浅处产生热量,穿透深度为5~40 μm。采用激光进行牙龈切除后创口愈合的速度受激光发射波长、功率、波形(连续或脉冲)和照射时间等参数的影响。临床医师需根据组织原发色素和组织生物型选择合适的激光类型并进行参数设置。Nd:YAG激光和半导体激光易被色素团吸收,对于血红蛋白含量高(如血管性龈瘤)和黑色素严重着色的牙龈组织,使用相对较小的能量密度即可实现牙龈的切除;而在治疗纤维化的牙龈组织时,需要较低的功率设置,以控制激光热量避免引起组织损伤。铒激光和CO2激光水吸收率高,因此应用于切除充血的牙龈组织时需要更低的功率设置。已有随机对照研究表明应用半导体激光和CO2激光辅助牙周切除性手术可以获得良好的效果,但关于Nd:YAG激光和铒激光在辅助牙周切除性手术中应用的报道多为病例报告。不同类型激光应用于牙周切除性手术中的参数设置也有差异。综合文献报道和临床应用,Nd:YAG激光进行牙龈切除时通常设置能量为20~200 mJ,频率为10~100 Hz。铒激光进行牙龈切除时应采用接触式,设置能量为100~150 mJ,频率为25~35 Hz;铒激光进行牙龈修整时,需设置更低的能量和频率,通常能量为40~50 mJ,频率为10~20 Hz。半导体激光进行牙龈切除和成形时是采用连续波模式,功率通常设置为1~1.5 W(表1[7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19])。值得注意的是,传统手术器械可以进行侧方切割和末端切割,而激光主要为末端切割,因此,为了实现牙龈切除术的外斜切口,需要调整手术方式。
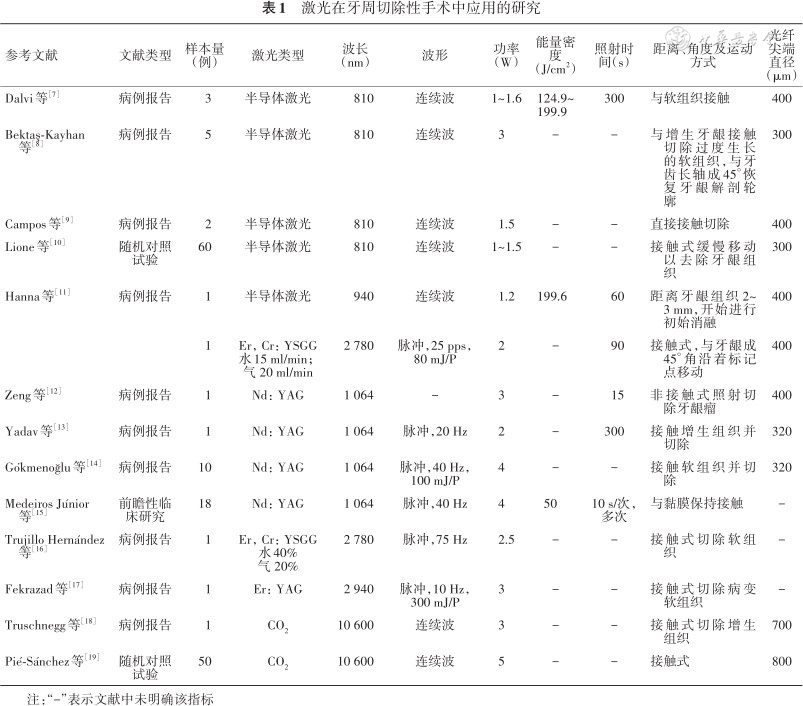
激光在牙周切除性手术中应用的研究
激光在牙周切除性手术中应用的研究
| 参考文献 | 文献类型 | 样本量(例) | 激光类型 | 波长(nm) | 波形 | 功率(W) | 能量密度 (J/cm2) | 照射时间(s) | 距离、角度及运动方式 | 光纤尖端直径(μm) |
|---|---|---|---|---|---|---|---|---|---|---|
| Dalvi等[7] | 病例报告 | 3 | 半导体激光 | 810 | 连续波 | 1~1.6 | 124.9~ 199.9 | 300 | 与软组织接触 | 400 |
| Bektaş-Kayhan等[8] | 病例报告 | 5 | 半导体激光 | 810 | 连续波 | 3 | - | - | 与增生牙龈接触切除过度生长的软组织,与牙齿长轴成45°恢复牙龈解剖轮廓 | 300 |
| Campos等[9] | 病例报告 | 2 | 半导体激光 | 810 | 连续波 | 1.5 | - | - | 直接接触切除 | 400 |
| Lione等[10] | 随机对照试验 | 60 | 半导体激光 | 810 | 连续波 | 1~1.5 | - | - | 接触式缓慢移动以去除牙龈组织 | 300 |
| Hanna等[11] | 病例报告 | 1 | 半导体激光 | 940 | 连续波 | 1.2 | 199.6 | 60 | 距离牙龈组织2~3 mm,开始进行初始消融 | 400 |
| 1 | Er,Cr:YSGG 水15 ml/min;气 20 ml/min | 2 780 | 脉冲,25 pps,80 mJ/P | 2 | - | 90 | 接触式,与牙龈成45°角沿着标记点移动 | 400 | ||
| Zeng等[12] | 病例报告 | 1 | Nd:YAG | 1 064 | - | 3 | - | 15 | 非接触式照射切除牙龈瘤 | 400 |
| Yadav等[13] | 病例报告 | 1 | Nd:YAG | 1 064 | 脉冲,20 Hz | 2 | - | 300 | 接触增生组织并切除 | 320 |
| Gökmenoğlu等[14] | 病例报告 | 10 | Nd:YAG | 1 064 | 脉冲,40 Hz,100 mJ/P | 4 | - | - | 接触软组织并切除 | 320 |
| Medeiros Júnior等[15] | 前瞻性临床研究 | 18 | Nd:YAG | 1 064 | 脉冲,40 Hz | 4 | 50 | 10 s/次,多次 | 与黏膜保持接触 | - |
| Trujillo Hernández等[16] | 病例报告 | 1 | Er,Cr:YSGG 水40% 气 20% | 2 780 | 脉冲,75 Hz | 2.5 | - | - | 接触式切除软组织 | - |
| Fekrazad等[17] | 病例报告 | 1 | Er:YAG | 2 940 | 脉冲,10 Hz,300 mJ/P | 3 | - | - | 接触式切除病变软组织 | - |
| Truschnegg等[18] | 病例报告 | 1 | CO2 | 10 600 | 连续波 | 3 | - | - | 接触式切除增生组织 | 700 |
| Pié-Sánchez等[19] | 随机对照试验 | 50 | CO2 | 10 600 | 连续波 | 5 | - | - | 接触式 | 800 |
注:“-”表示文献中未明确该指标
2. 重建性手术:重建性手术的目的在于使牙周袋变浅,重建牙龈和牙槽骨的生理外形,1974年Ramfjord和Nissle[20]提出的改良Widman翻瓣术是目前临床应用最广泛的牙周重建性手术术式。该术式主要适用于:①经牙周基础治疗后,牙周袋仍在5 mm以上或复杂性牙周袋,且探诊后出血;②需要在直视下平整根面并暴露根分叉,或截除某一患根的患者。激光可应用于牙周翻瓣术的手术切口、去除肉芽组织、根面平整和牙槽骨修整等环节。在术区切开时,激光既可用于修整牙龈,减少牙龈厚度,还可以进行术区的消融止血;在手术切开翻开龈瓣后,激光可用于去除残留的牙石及肉芽组织,并进行根面平整。在此过程中,深度穿透型激光(Nd:YAG激光和半导体激光)具有去龈沟上皮和肉芽组织及抗菌的特性,但在去除根面牙石和根面平整中的作用有限。铒激光可以去除龈下牙石和坏死的牙骨质,达到根面清创的效果,并为结缔组织或上皮的附着提供具有良好生物相容性的牙根面。此外,由于铒激光对羟基磷灰石和水均有较高的吸收系数,故在翻瓣术中还常被应用于纠正骨病损和畸形。Gabrić等[21]通过动物模型研究比较Er:YAG激光在接触和非接触模式下与超声骨刀截骨后骨愈合的情况,发现术后3周非接触模式Er:YAG激光手术组大鼠截骨处的愈合速度最快。与传统钻针进行种植位点预备相比,Er:YAG激光预备后可使种植体局部形成更多的板层骨,减少坏死骨的形成[22]。
3. 再生性手术:Melcher[23]提出在牙周手术后,不同类型的细胞将重新附着于牙根表面,从而决定愈合的方式是“再附着”还是“新附着”形成。理想的牙周治疗效果是减缓牙周袋内的上皮迁移,促进新的结缔组织附着形成,这就需要引导牙周膜细胞先于牙龈上皮细胞定植于牙根面。GTR是在手术过程中利用膜性材料隔开移行的上皮和结缔组织,使具有产生牙骨质、牙周膜和牙槽骨功能的牙周膜细胞增殖并迁移至愈合位点,实现牙周组织再生[24]。研究表明,激光可通过影响术区创口愈合和根面生物改性从而影响GTR术后牙周组织再生的效果[25]。激光处理的牙龈创口出现上皮化延迟,有利于新附着的形成,其可能机制是:①激光处理牙龈边缘形成焦痂,阻碍上皮细胞迁移;②激光处理牙龈后,局部炎症反应低,不利于上皮迁移。已有多项研究显示激光在根面生物改性,促进新附着形成中的应用[26, 27]。铒激光可有效去除根面的牙结石,促进细胞增殖和分化。Mizutani等[28]通过建立比格犬牙周炎模型研究发现,与传统手用器械根面处理组相比,Er:YAG激光处理组在术后3个月骨再生效果更显著。另外,Theodoro等[29]对半导体激光促进骨再生的效果进行研究发现,经半导体激光照射的大鼠骨缺损区周围的骨组织中成骨标志物骨钙素表达显著上调。体外研究表明,PBM处理可通过对骨组织的生物刺激作用,促进成骨细胞增殖分化从而有利于骨再生[30]。但目前尚无足够的证据支持半导体激光和PBM治疗在牙周再生性手术中的有益效果。关于Nd:YAG激光在延迟创口再上皮化中的作用也需要更多的组织学证据支持。
4. 美容性手术:随着患者对口腔健康观念的转变,牙周美容性手术受到越来越多的关注。牙冠延长术是一种以解决美观与实现功能修复为目的的牙周手术,需要根据术区患牙的附着龈宽度、生物学宽度和牙槽骨高度等因素,确定牙龈成形方式及是否需要进行骨修整。附着龈宽度是选择牙龈成形方式的重要考量,当附着龈宽度足够,膜龈联合位于牙槽嵴顶的根方时,可选择牙龈切除术。口腔治疗常用的深度穿透型激光(Nd:YAG激光和半导体激光)和表面吸收型激光(CO2激光和铒激光)均可以实现精准的牙龈切除术。但铒激光止血效果欠佳,使用铒激光进行牙龈切除后,可辅助使用深度穿透型激光进行术区止血处理。当牙齿被动萌出不足或者修复体边缘侵犯生物学宽度时,需要翻瓣术结合骨修整术,降低龈缘和牙槽嵴顶的位置,以保持生物学宽度并延长临床牙冠。传统钻针通过机械运动进行骨修整,这一过程中机械摩擦产生的热量可能引起骨的灼伤。铒激光具有良好的控深能力,在对骨组织进行精确切割的同时而不带来热损伤,被广泛应用于辅助冠延长术中的骨修整。2004年,Flax和Radz[31]提出闭合瓣冠延长术,该术式在盲探下建立骨水平,利用铒激光进行骨切除,无需翻瓣和缝合,缩短了手术时间,还具有增加术后牙龈位置稳定性等优势。闭合瓣冠延长术是一项技术敏感性很高的术式,激光的功率大小、光纤角度和运动方向等因素均可影响闭合瓣冠延长术的效果。因此,在临床应用中,口腔医师需要进行规范化培训,根据术区涉及的牙位和去骨骨量,考虑是否采用闭合瓣冠延长术。当术区局限于1~2个牙位,且颊舌侧去骨量不超过2.5 mm时,可以选择铒激光进行闭合瓣冠延长术;当患者牙周状况不佳、术区涉及牙位数较多或患牙存在大范围牙体缺损时,需慎用闭合瓣冠延长术。
牙龈切除术、钻针磨除法和游离龈移植术是治疗牙龈色素沉着的常见手术方式。黑色素的吸收光谱为351~1 064 nm,牙龈组织中的黑色素细胞对Nd:YAG激光和半导体激光具有较高的吸收率。非接触式工作尖和接触式工作尖的Nd:YAG激光和半导体激光均可用于去除牙龈色素。低功率的Nd:YAG激光和半导体激光照射可以在不切割组织的情况下,将激光能量传递到上皮细胞深处的黑色素。当使用接触式工作尖进行操作时,可以采用光纤斜接触的方式,在牙龈表面快速地移动工作尖。如果工作尖端积聚了组织碎屑需要及时清理,避免激光被“激活”后,仅作用于组织表面。铒激光和CO2激光易被牙龈中的水分吸收,可以作用于牙龈表面,通过将牙龈组织层层剥离直至去除色素层。操作时需注意保护牙龈的边缘,薄龈生物型患者应谨慎使用铒激光和CO2激光去除牙龈色素。已有多项随机对照试验对半导体激光、Nd:YAG激光和铒激光去除牙龈色素沉着的效果进行研究,结果显示三者均可有效去除牙龈色素沉着。采用Nd:YAG激光去除牙龈色素沉着时,可设置能量为30~100 mJ,频率为20~100 Hz。使用铒激光去除牙龈色素时,多采用非接触式照射,能量设置为150~200 mJ,频率25~40 Hz,工作尖距离色素沉着区约2~3 mm处,激光光纤与牙龈呈70°~80°角放置。不同研究中使用半导体激光去除牙龈色素时的参数设置根据激光的具体型号不同差异较大(表2[32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45])。
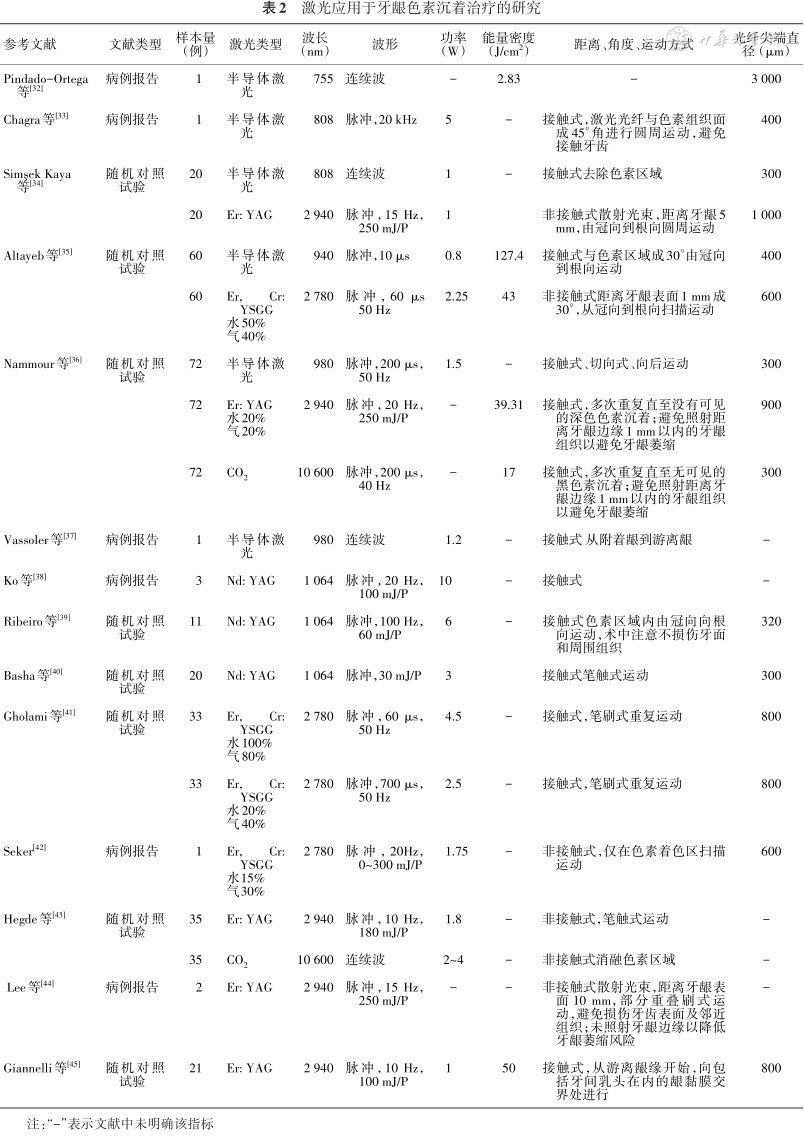
激光应用于牙龈色素沉着治疗的研究
激光应用于牙龈色素沉着治疗的研究
| 参考文献 | 文献类型 | 样本量(例) | 激光类型 | 波长(nm) | 波形 | 功率(W) | 能量密度(J/cm2) | 距离、角度、运动方式 | 光纤尖端直径(μm) |
|---|---|---|---|---|---|---|---|---|---|
| Pindado-Ortega等[32] | 病例报告 | 1 | 半导体激光 | 755 | 连续波 | - | 2.83 | - | 3 000 |
| Chagra等[33] | 病例报告 | 1 | 半导体激光 | 808 | 脉冲,20 kHz | 5 | - | 接触式,激光光纤与色素组织面成45°角进行圆周运动,避免接触牙齿 | 400 |
| Simşek Kaya等[34] | 随机对照试验 | 20 | 半导体激光 | 808 | 连续波 | 1 | - | 接触式去除色素区域 | 300 |
| 20 | Er: YAG | 2 940 | 脉冲,15 Hz,250 mJ/P | 1 | 非接触式散射光束,距离牙龈5 mm,由冠向到根向圆周运动 | 1 000 | |||
| Altayeb等[35] | 随机对照试验 | 60 | 半导体激光 | 940 | 脉冲,10 μs | 0.8 | 127.4 | 接触式与色素区域成30°由冠向到根向运动 | 400 |
| 60 | Er, Cr: YSGG 水50% 气40% | 2 780 | 脉冲,60 μs 50 Hz | 2.25 | 43 | 非接触式距离牙龈表面1 mm成30°,从冠向到根向扫描运动 | 600 | ||
| Nammour等[36] | 随机对照试验 | 72 | 半导体激光 | 980 | 脉冲,200 μs,50 Hz | 1.5 | - | 接触式、切向式、向后运动 | 300 |
| 72 | Er: YAG 水20% 气20% | 2 940 | 脉冲,20 Hz,250 mJ/P | - | 39.31 | 接触式,多次重复直至没有可见的深色色素沉着;避免照射距离牙龈边缘1 mm以内的牙龈组织以避免牙龈萎缩 | 900 | ||
| 72 | CO2 | 10 600 | 脉冲,200 μs,40 Hz | - | 17 | 接触式,多次重复直至无可见的黑色素沉着;避免照射距离牙龈边缘1 mm以内的牙龈组织以避免牙龈萎缩 | 300 | ||
| Vassoler等[37] | 病例报告 | 1 | 半导体激光 | 980 | 连续波 | 1.2 | - | 接触式 从附着龈到游离龈 | - |
| Ko等[38] | 病例报告 | 3 | Nd: YAG | 1 064 | 脉冲,20 Hz,100 mJ/P | 10 | - | 接触式 | - |
| Ribeiro等[39] | 随机对照试验 | 11 | Nd: YAG | 1 064 | 脉冲,100 Hz,60 mJ/P | 6 | - | 接触式色素区域内由冠向向根向运动,术中注意不损伤牙面和周围组织 | 320 |
| Basha等[40] | 随机对照试验 | 20 | Nd: YAG | 1 064 | 脉冲,30 mJ/P | 3 | 接触式笔触式运动 | 300 | |
| Gholami等[41] | 随机对照试验 | 33 | Er, Cr: YSGG 水100% 气80% | 2 780 | 脉冲,60 μs,50 Hz | 4.5 | - | 接触式,笔刷式重复运动 | 800 |
| 33 | Er, Cr: YSGG 水20% 气40% | 2 780 | 脉冲,700 μs,50 Hz | 2.5 | - | 接触式,笔刷式重复运动 | 800 | ||
| Seker[42] | 病例报告 | 1 | Er, Cr: YSGG 水15% 气30% | 2 780 | 脉冲,20Hz,0~300 mJ/P | 1.75 | - | 非接触式,仅在色素着色区扫描运动 | 600 |
| Hegde等[43] | 随机对照试验 | 35 | Er: YAG | 2 940 | 脉冲,10 Hz,180 mJ/P | 1.8 | - | 非接触式,笔触式运动 | - |
| 35 | CO2 | 10 600 | 连续波 | 2~4 | - | 非接触式消融色素区域 | - | ||
| Lee等[44] | 病例报告 | 2 | Er: YAG | 2 940 | 脉冲,15 Hz,250 mJ/P | - | - | 非接触式散射光束,距离牙龈表面10 mm,部分重叠刷式运动,避免损伤牙齿表面及邻近组织;未照射牙龈边缘以降低牙龈萎缩风险 | - |
| Giannelli等[45] | 随机对照试验 | 21 | Er: YAG | 2 940 | 脉冲,10 Hz,100 mJ/P | 1 | 50 | 接触式,从游离龈缘开始,向包括牙间乳头在内的龈黏膜交界处进行 | 800 |
注:“-”表示文献中未明确该指标
激光还可用于膜龈手术中,如直接使用激光从上腭等部位获取游离龈瓣,以及在手术刀取瓣后采用激光封闭创口,减少术区出血。目前关于激光辅助膜龈手术的效果尚缺乏设计良好的随机对照临床试验进行证实,激光在软组织处理方面的一系列优势及病例报道均展示出激光在辅助膜龈手术方面具有良好的前景。
激光作为一种辅助牙周手术治疗的方式,与传统牙周手术治疗相比具有以下4方面优势:①激光能减少手术区域细菌和其他病原体的数量,切口不易感染;②激光可封闭血管和淋巴管,减少术后肿胀和疼痛,一些表浅的软组织手术仅需使用表面麻醉;③激光具有极佳的止血效果,使术区视野更加清晰,减少术区缝合需求;④激光可以实现对组织更有选择性和精准的修整。激光辅助牙周手术治疗更符合微创口腔医学的理念,为伴系统性疾病患者和妊娠期患者的牙周手术治疗提供了更加安全、有效和舒适的治疗手段。在多种牙周术式中使用激光辅助治疗,主要目的是实现牙周软组织的切割和(或)骨组织的修整,其疗效受激光器的参数、生物组织的特性和临床医师操作的影响。
美学冠延长术常同时涉及牙龈切除术、骨成形术、翻瓣和根面平整等,这些术式和步骤可使用激光进行辅助治疗,因此,以激光辅助美学冠延长术的规范化操作流程为例,介绍激光辅助牙周手术治疗的操作注意要点。第一,术前制作手术导板或通过Chu比例测量尺确定牙龈边缘根向延伸的范围。第二,局部麻醉后将手术导板或Chu比例测量尺就位,选用一种深度穿透型(Nd:YAG激光和半导体激光)或表面吸收型激光(CO2激光和铒激光)标记出切口的轮廓。根据选择的激光类型调整适宜的参数,切口轮廓的标记尽量在低能量不聚焦的模式下进行。由于激光为末端切割,为了实现类似于手术刀片的外斜切口需要调整操作方式。初始切口应稍高于导板顶端,将激光工作尖以45°外斜角的方式单向缓慢地移动。当牙龈边缘较厚时,可选择较低的功率将激光工作尖以横扫的方式移动,调整牙龈的厚度和形态。操作过程中注意保护龈乳头。在接近牙根时,需谨慎操作,避免激光对牙体硬组织造成损伤。在使用铒激光进行牙龈切除时,可联合使用深度穿透型激光进行止血。第三,翻起全厚瓣,铒激光可去除肉芽组织、根面的牙石和内毒素。其他类型的激光可以去除肉芽组织,并对术区进行去上皮化,建议使用较牙龈切除术能量小的激光参数。第四,采用冠延长测量尺确定牙槽骨嵴的位置,使用铒激光对骨组织进行精确切割(300 mJ/25 Hz)和骨面抛光(100 mJ/30 Hz),建立生物学宽度。根据激光器的型号调整具体参数。第五,龈瓣复位缝合,对出血较多的术区,可使用Nd:YAG激光和半导体激光止血。
随着社会老龄化进程加快,越来越多老年患者和伴有复杂全身健康问题的患者有牙周手术治疗的需求,这对牙周手术治疗的微创、安全性和舒适度等方面提出了更高的要求。作为一种多潜能的治疗方式,激光为牙周病治疗尤其是牙周手术治疗带来了显著的益处。激光辅助牙周手术可在实现治疗目的的前提下减小手术创口,降低术后感染风险,使患者的体验更舒适。Nd:YAG激光、半导体激光、铒激光和CO2激光发射不同波长的电磁波,可对牙周软组织和硬组织发挥其特有的效应。如果临床医师可以根据不同类型的牙周手术选择合适波长的激光,掌握激光参数的设置和操作技巧(如功率、能量密度和光束的方向等)以保证治疗的效果,激光就是应用于牙周手术治疗的一种优秀的工具。随着激光技术的持续发展,将有越来越多的临床医师发现这种微创和多潜能治疗方式与传统技术相比所具有的优越性。临床医师不断积累经验后,激光在牙周手术治疗中的应用范围也将不断拓展。
刘程程, 孟姝, 丁一. 激光辅助牙周手术治疗原理与操作常规[J]. 中华口腔医学杂志, 2023, 58(5): 497-504. DOI: 10.3760/cma.j.cn112144-20230228-00063.
所有作者声明不存在利益冲突
1. 激光与组织的相互作用不包括()
A. 传播
B. 吸收
C. 透射
D. 反射
2. 激光辅助牙周手术治疗主要是应用其哪种效应()
A. 光化效应
B. 光生物效应
C. 光热效应
D. 光压效应
3. 适用于牙周软组织切割的激光包括()
A. CO2激光
B. 半导体激光
C. 铒激光
D. 以上都是
4. 下列哪种激光最适合应用于牙槽骨修整()
A. CO2激光
B. 铒激光
C. 半导体激光
D. Nd:YAG激光
5. 激光应用于牙周手术治疗的优势包括()
A. 良好的杀菌作用
B. 极佳的止血效果
C. 可减少术后肿胀和疼痛
D. 以上都是



























