
脊髓性肌萎缩症(SMA)是一种常见的退行性神经肌肉疾病,表现为进行性肌肉无力和萎缩。近年来,相继出现的疾病修正治疗药物改变了SMA的自然病程,症状前诊断并给予疾病修正治疗优于症状后治疗。为此,本共识组织全国相关领域专家,围绕以下主题达成共识:SMA新生儿筛查流程与相关问题、SMA筛查后确诊流程与相关问题、筛查确诊SMA新生儿的疾病管理等,以期规范和指导当前SMA的新生儿筛查工作。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脊髓性肌萎缩症(SMA)是一种由于脊髓前角α-运动神经元退化变性,导致肢体和躯干进行性、对称性肌无力和肌萎缩的常染色体隐性遗传性疾病,常伴有呼吸、消化和骨骼等多系统损害[1]。临床上以运动神经元存活基因1(SMN1)缺失和(或)微小变异导致的5q SMA类型最为常见。新生儿的SMA发病率约为1/10 000[1];中国人群SMN1基因7号外显子缺失携带率为1/42~1/48[2]。SMA具有高致残和致死率。已上市的三款SMA疾病修正药物(诺西那生钠、利司扑兰和索伐瑞韦)可显著改善疾病预后,改变疾病自然病程。SMA的新生儿于症状前诊断并给予疾病修正治疗,优于症状后治疗[3]。目前大多数欧美国家及日本、韩国等亚洲国家均已开展全国范围的SMA新生儿筛查[4, 5, 6]。近年来,中国大陆和台湾地区也有多个SMA新生儿筛查研究[7, 8]。2021年《中国新生儿筛查专家共识:高通量测序在单基因病筛查中的应用》[9]中也将SMA纳入建议筛查疾病列表。SMA的新生儿筛查工作将在国内广泛开展与推广,此时迫切需要相关领域的指南来指导、规范相关工作。在此背景下,中国研究型医学学会神经科学专业委员会联合中国出生缺陷干预救助基金会神经与肌肉疾病防控专项基金组织专家组,开展本共识的撰写。
本共识以“脊髓性肌萎缩症、新生儿筛查、遗传学诊断、治疗、运动神经元基因、SMN基因、实践指南、专家共识、研究进展、多学科、神经肌肉疾病、疫苗;newborn screening、neonatal screening、spinal muscular atrophy、dried blood spot screening、rare diseases、public health、newborn bloodspot screening、epidemiology、birth prevalence、neuromuscular disease”等为检索词,以Pubmed、web of science、EMBASE、中国知网、万方医学、中国生物医学文献数据库等数据库为检索范围,检索2000年1月至2023年3月发表的相关国内外SMA新生儿筛查实践和国际指南共识为参照,由新生儿筛查学、医学遗传学及临床医学等领域的29位专家反复讨论制订,并发放给全国不同等级医院相关专业医生,提出意见并综合整理修改,旨在为实验室人员和医生的临床诊疗提供指导和帮助。本共识以“问题,推荐意见”为框架对每一条推荐意见进行投票。对有争议的推荐意见多次讨论,循证共识,最终得出推荐意见。
1. SMA新生儿筛查的目标疾病与基因:研究证明95%的SMA患者存在SMN1基因7号外显子的纯合缺失[10],且基因型-表型关联明确。因此针对SMN1基因7号外显子纯合缺失的筛查方法可靠,适宜在全体新生儿范围内进行推广。未累及SMN1基因7号外显子纯合缺失的其他SMN1变异所致的SMA,因缺乏热点变异位点且不能被常用的SMN1基因7号外显子拷贝数定量方法检出,尚不具备纳入新生儿筛查的条件。美国新生儿统一筛查推荐疾病列表(RUSP)也明确将SMA列为“由SMN1基因7号外显子纯合缺失所致的疾病”[10]。因此,现阶段SMA新生儿筛查的目标疾病仅包括累及SMN1基因7号外显子纯合缺失所致的SMA。由SMN1基因的其他类型突变所致的SMA及非SMN1基因突变所致的SMA尚未纳入SMA新生儿筛查的目标疾病,此类SMA患者尚无法通过目前采用的新生儿筛查方法被检出,应在知情同意中明确告知。
2. SMA新生儿筛查的方法及其筛查效能:SMN1基因7号外显子纯合缺失有多种不同检测方法可供选择。筛查一般采用针对7号外显子的定量检测方法,如荧光定量聚合酶链反应(PCR)、多重连接依赖的探针扩增技术(MLPA)、变性高效液相色谱(DHPLC)等。筛查机构应根据国家法规要求、行业技术规范和本机构实验室的实际情况等选择适宜的方法开展筛查。虽然通过定量技术判断SMN1基因7号外显子纯合缺失是可靠且成熟的方法,但是对于筛查而言,受限于样本质量等多重因素,仍无法完全排除假阳性和假阴性的可能。综合我国国家药品监督管理局已注册产品的性能指标、临床常用方法学技术特征和国内外新生儿筛查研究报告数据等,筛查机构选择的筛查方法对于SMN1基因7号外显子纯合缺失的检测敏感性应≥95%,阳性预测值应≥90%[4, 5, 6,11, 12, 13, 14]。
SMN2基因拷贝数是SMA的重要修饰因素,但并非筛查检测所必须,并且可能会增加筛查成本。因此,临床开展SMA新生儿筛查可以不包括定量检测SMN2基因拷贝数。但SMN2基因拷贝数对确诊SMA新生儿的后续临床治疗有重要指导价值,因此筛查阳性的新生儿的确诊试验应包含SMN2基因拷贝数信息。
3. SMA新生儿筛查的操作流程:新生儿筛查的程序包括健康教育与知情同意、标本采集与递送、实验室检测、阳性病例确诊、分型及治疗与随访等众多环节,具体程序可见筛查、确诊及疾病管理流程图(图1)。SMA新生儿筛查实验室所在医疗机构、技术人员和仪器试剂的资质以及实验室工作区域及仪器配置、数据解读和质量控制等方面均应符合我国《新生儿疾病筛查技术规范(2010版)》和《医疗机构临床基因扩增检验实验室管理办法》的相关规定要求[15, 16]。SMA新生儿筛查为基因筛查,基本不受孕周、出生时间、蛋白负荷、进食及药物等因素的影响,对血片采集时间亦无特定要求,但建议与我国目前现行的新生儿筛查同时采集或尽早采集。不含白细胞成分的输血治疗不影响样本采集(全血输注者应在3个月后采集);对于拟行骨髓移植或干细胞移植的新生儿应在治疗前完成采集。为避免因DNA质量影响实验室检测效率,建议用于检测的滤纸干血斑直径应≥6 mm。
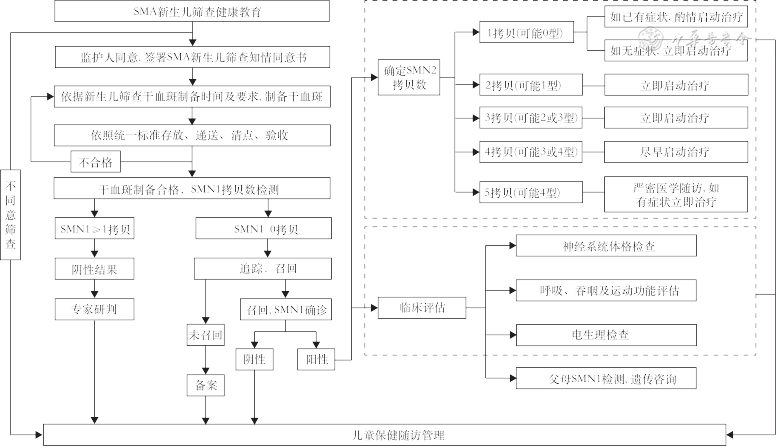

注:SMA为脊髓性肌萎缩症;SMN2为运动神经元存活基因2;SMN1为运动神经元存活基因1
4. SMA新生儿筛查的质量控制:筛查实验室应建立并重视SMA新生儿筛查的质量控制。应采用与采集样本(滤纸干血片)相匹配的DNA提取试剂盒,保证样本DNA能够达到所选用的SMN1基因检测试剂盒的要求。应建立新生儿SMA筛查检测的质量管理体系:(1)对采用的检测系统的性能进行验证或确认,评估结果与选用的试剂盒操作说明书一致,方可用于临床服务;(2)实验室应建立适当的室内质量控制规则以监控系统误差和随机误差,做好质量控制记录并定期分析,持续改进;(3)根据所选用检测试剂盒性能指标与本地检测数据,确定SMN1基因7号外显子纯合缺失筛查的阳性切值,以保证检测敏感性和阳性预测值符合本专家共识的建议。专家组建议在筛查实践中开展系统性研究,推动建立SMN1基因7号外显子纯合缺失全国性的室间质量评价标准。
推荐意见1:目前SMA筛查仅针对SMN1基因7号外显子纯合缺失类型(同意率100%);筛查机构选择的筛查方法对于SMN1基因7号外显子纯合缺失的检测敏感性应≥95%,阳性预测值应≥90%(同意率100%);SMA新生儿筛查可以不包括定量检测SMN2基因拷贝数,但筛查阳性新生儿的确诊试验应包含SMN2基因拷贝数信息(同意率100%);用于检测的滤纸干血斑直径应≥6 mm,全血输注者应在3个月后采集血标本,对于拟行骨髓移植或干细胞移植的新生儿应在治疗前完成采集(同意率100%)。
1.筛查阳性后的家系召回和咨询:发现标本筛查阳性的新生儿,应立即召回,同时采集核心家系成员全血进行确诊性基因检测。确诊实验应包括SMN1及SMN2拷贝数检测,同时对患儿进行详细的体格检查,并行运动功能及电生理等评估,以便尽早确诊,依据SMN2拷贝数并结合临床评估以决策治疗。
2.筛查假阳性的原因:新生儿SMA筛查假阳性的概率极低,其大多由筛查流程缺少规范化与检测技术本身的局限性所造成[17]。如:新生儿筛查滤纸干血片质量不高(血量少,血斑污染,血片高温、高湿环境保存或血片递送不当等)、筛查实验室方法的选择及临界值的确定不准确、实验室技术人员操作欠规范和新生儿白细胞计数降低等因素均可引起假阳性[18]。
3.与筛查阳性的新生儿监护人沟通与咨询的内容:与筛查阳性的新生儿监护人进行充分沟通,并提供疾病相关的咨询,对SMA新生儿筛查及后期疾病管理至关重要。建议沟通与咨询应包括以下内容:(1)疾病相关信息、筛查结果及其代表的意义;(2)筛查技术存在的局限性和目前结果存在的各种可能性;(3)立即到指定的具备诊断资质医疗机构,采集新生儿及核心家系成员血样本(新生儿和生物学父母)进行确诊实验,神经肌肉病专家同步检查和评估新生儿临床指标;(4)告知确诊实验所采用的技术、风险及局限性;(5)明确告知:如确诊试验为阴性,仍需定期随访并纳入儿童保健系统管理;如确诊为阳性,立即参与由儿童神经病学和医学遗传学等医生组成的医疗团队的治疗讨论,选择个体化诊疗方案,建议监护人积极接受并参与由政府、社会组织等(特殊疾病救助渠道、病患组织、病友群等)提供的各种帮助,树立长期随访的准备和信心[19];(6)在确诊的等待期,家长(监护人)需要密切关注新生儿运动、喂养和呼吸等方面的表现,一旦出现异常表现(如哭声变弱、喂养困难、已获得的运动功能减退或丧失、运动能力落后于年龄、腹式呼吸和生长障碍等),则需立即就医[20, 21]。遗传咨询首先应获取监护人的信任,以通俗易懂的语言解释问题,真诚温暖的方式缓解和抚慰监护人焦虑情绪[22]。
4.对召回的阳性新生儿及其核心家系成员的确诊实验:对召回的阳性新生儿及其核心家系成员应立即进行确诊实验。根据国内外的SMA遗传学诊断共识[23, 24],确诊实验推荐定量分析的技术,如国际公认的金标准技术MLPA、液滴数字PCR(ddPCR)、荧光定量PCR技术等[19]。召回新生儿的确诊实验需同时包括SMN2拷贝数的检测,有助于SMA分型预判、症状前治疗策略的制定及后期随访规划。核心家系成员SMN1基因型等遗传传递信息亦需检测,为进一步的遗传咨询提供支持。
1型SMA的平均发病年龄是2~3个月[25, 26],最严重的1a型通常<1个月。为了能够及时开展症状前治疗,确诊实验建议在2周内完成,应依据《脊髓性肌萎缩症遗传学诊断专家共识》[24]出具规范化的基因诊断报告。根据国内外的SMA新生儿筛查实践经验,自出生进行新生儿筛查再到确诊实验的完成,周期为15~30 d[17, 18,27]。
确诊实验需警惕标本污染导致的假阴性,要确保标本留取、运输及实验的规范化与准确性。同时要警惕假阳性,譬如位于探针杂交区域或者引物结合位置的变异会导致杂交或者扩增失败而出现假阳性[17],但是这些情况发生的概率较低。
5.确诊实验完成后与家属沟通的内容:确诊实验完成后,需再次与召回的新生儿筛查阳性家庭进行沟通,提供咨询和指导。建议沟通内容主要包括:(1)确诊实验结果为阳性,应立即联系医学遗传学专家和儿童神经病学专家团队报告确诊实验的结果并进行讨论,由上述专家团队对讨论的结果进行解释,告知疾病相关信息、家系遗传传递规律和再发风险评估;同时建议家系其他成员进行扩展性筛查,以期早期明确其他成员是否患病及存在的风险。由SMA专科诊治医生为确诊阳性患儿进行认知、语言、运动功能、喂养、呼吸和睡眠等的评估,依据临床评估与SMN2拷贝数制定个体化治疗策略,同时提供后期多学科的管理和日常护理指导。(2)确诊实验结果为阴性,同样需要及时联系医学遗传学专家和儿童神经病学专家报告实验结果,由遗传专家或儿科神经学专家对筛查的家庭进行遗传咨询和指导:解释筛查阳性而确诊阴性的原因及可能存在的复合杂合突变类型SMA等残余风险(风险约为5%);同时建议针对这些家庭制定随访计划,每3个月随访一次,至2岁结束,指导家长密切关注孩子的认知、语言、运动功能、呼吸、消化和睡眠等的发育与变化,及时发现异常情况,及早就诊获得医疗帮助和支持。
推荐意见2:发现筛查阳性的标本,应立即召回对应的新生儿,依据SMN2拷贝数结合临床评估决策治疗(同意率100%);确诊实验推荐定量分析的技术,如国际公认的金标准技术MLPA、ddPCR、荧光定量PCR技术等(同意率100%);确诊实验建议应在2周内完成,自出生进行新生儿筛查到确诊实验的完成,建议周期为15~30 d(同意率100%)。
1.筛查确诊后SMA新生儿治疗策略选择:经新生儿筛查确诊阳性的(有/无症状)SMA患儿均需要及时制定个体化治疗与疾病管理方案。药物治疗选择,需根据国内已获批药物的适应症进行合理临床应用。多个国家的SMA新生儿筛查治疗专家共识或相关临床研究建议将SMN2拷贝数作为是否启动症状前治疗的生物标志物[28, 29, 30, 31]。
SMN2拷贝数为1且已出现临床症状的SMA患儿,依据家长意愿酌情考虑是否启动治疗;SMN2拷贝数为1的无症状的SMA患儿及SMN2拷贝数为2(临床分型最可能为1或2型)或拷贝数为3(临床分型最可能为2或3型)的无症状SMA患儿,均建议立即启动治疗;SMN2拷贝数为4的无症状SMA患儿(预测未来临床分型为3或4型),建议尽早启动疾病修正治疗[32, 33];SMN2拷贝数为5的无症状SMA患儿建议严密观察及随访,暂不立即启动治疗[32](图1)。
2.筛查确诊后SMA新生儿的随访管理:新生儿筛查确诊的SMA患儿需接受长期、规范的医学随访。SMN2拷贝数为1~4的无症状SMA患儿在接受治疗后应每3个月完成1次医学随访[12]。因各种原因未能及时接受治疗的无症状SMA患儿,6月龄内的建议每月随访1次;6月龄至2岁的建议每2~3个月随访1次;2岁以上的每6~12个月随访1次。常规随访内容建议包括尺神经或腓神经复合肌肉动作电位(CMAP)波幅等电生理检查、神经系统体格检查以及运动量表费城儿童医院婴儿神经肌肉性疾病测试(CHOP INTEND)、Hammersmith婴儿神经系统检查(HINE)、Hammersmith运动功能量表扩展版(HEMSE)等相关评估[12,28]。
未接受疾病修正治疗的无症状患儿,随访过程中需密切监测SMA的发病预警信号,一旦患儿出现吞咽能力或呼吸模式的显著变化、已获得的运动能力出现下降或预期运动能力未能获得以及CMAP波幅低于同年龄正常值等相关征象,建议立即启动疾病修正治疗。对症状性SMA患儿,推荐成立多学科联合门诊,针对不同功能状态的患者,制定个体化诊疗建议,包括神经、康复、骨科、呼吸、消化、营养及护理等在内的多学科管理应贯穿于SMA疾病治疗的全过程[34, 35]。
推荐意见3:SMN2拷贝数为1且已出现临床症状的SMA患儿,依据家长意愿酌情考虑是否启动治疗(同意率100%);SMN2拷贝数为1的无症状的SMA患儿及SMN2拷贝数为2或3的无症状SMA患儿均建议立即启动治疗(同意率100%);SMN2拷贝数为4的无症状SMA患儿,建议尽早启动疾病修正治疗(同意率100%);SMN2拷贝数为5的无症状SMA患儿建议严密观察随访,暂不立即启动治疗(同意率100%)。
推荐意见4:SMN2拷贝数为1~4的无症状SMA患儿在接受治疗后应每3个月完成1次医学随访(同意率100%)。因各种原因未能及时接受治疗的无症状SMA患儿,6月龄内的建议每月随访1次;6月龄~2岁的建议每2~3个月随访1次;2岁以上的每6~12个月随访1次(同意率100%)。
对于经新生儿筛查确诊后的无症状的SMA患儿可按我国儿童疫苗接种程序接种,必要时进行疫苗接种相关评估,尤其需特别关注并及时接种肺炎疫苗或流感疫苗等呼吸道疾病相关的疫苗[36]。尽管目前尚无SMA患者接种疫苗与疾病修正治疗药物疗效或及安全性相关的研究报道,但不建议在免疫接种后72 h内进行疾病修正治疗;有建议接种7 d后无不良反应发生者,可进行诺西那生钠鞘内注射治疗[37, 38]。
推荐意见5:无症状的SMA患儿可按我国儿童疫苗接种程序接种(同意率100%);不建议在免疫接种后72 h内进行疾病修正治疗(同意率100%)。
SMA疾病修正治疗药物的症状前应用可显著改善患儿预后,而新生儿筛查则是发现症状前SMA患者的最佳途径。因此,开展SMA新生儿筛查已成为当前全球新生儿疾病筛查的热点。SMA疾病修正治疗药物诺西那生和利司扑兰分别于2022年和2023年被纳入国家医保目录,使得在我国开展SMA新生儿筛查的条件充分成熟。在知情同意下,严格遵守操作流程与质量控制,筛查由SMN1基因7号外显子纯合缺失所致的SMA患儿,技术成熟,路径方便可行。确诊后,依据SMN2拷贝数及临床症状,选择酌情或及时或立即给予药物治疗,对所有患者进行定期、规范化、多学科综合随访管理,使患者得到最大获益。SMA新生儿筛查工作不仅关系到技术,也是公共卫生政策的组成部分。在我国,SMA筛查的实施还面临疾病知晓率低、筛查费用支付高、治疗与康复普及困难等多方面挑战。因此,SMA新生儿筛查应在知情同意与自主选择的原则下,在有条件的单位和地区逐步开展。
本共识仅代表参与编写讨论专家的观点,不具备法律效力。共识发布后,中国研究型医院学会神经科学专业委员会将随时关注相关领域的证据变化情况,按照共识方法学要求,每年回顾相关推荐意见的证据变化,根据变化情况组织本领域专家对推荐意见进行相应修订,一般情况下每3~5年对共识进行一次全面修订。
本共识编写专家委员会名单
执笔人:张淑(解放军总医院第一医学中心神经内科);季星(上海交通大学医学院附属新华医院发育行为儿童保健科);瞿宇晋(首都儿科研究所遗传研究室);毛姗姗(浙江大学医学院附属儿童医院神经内科);田国力[上海市儿童医院(上海交通大学医学院附属儿童医院)新生儿筛查中心];杨茹莱(国家儿童健康与疾病临床医学研究中心 浙江大学医学院附属儿童医院遗传与代谢科);吴士文(解放军总医院第一医学中心神经内科)
专家组成员(按姓氏汉语拼音排序):艾戎(贵州医科大学附属医院儿科);郝胜菊(甘肃省妇幼保健院医学遗传中心);洪思琦(重庆医科大学附属儿童医院神经内科);胡君(福建医科大学附属协和医院儿科);季星(上海交通大学医学院附属新华医院发育行为儿童保健科);林烨(解放军总医院第一医学中心神经内科);刘丽(广州市妇女儿童医疗中心遗传与内分泌科);路新国(深圳市儿童医院神经内科);罗蓉(四川大学华西第二医院儿童神经科);毛姗姗(浙江大学医学院附属儿童医院神经内科);彭镜(中南大学湘雅医院儿科);漆洪波(重庆医科大学附属妇女儿童医院妇产科);瞿宇晋(首都儿科研究所遗传研究室);宋昉(首都儿科研究所遗传研究室);孙丹(华中科技大学附属武汉儿童医院神经内科);田国力[上海市儿童医院(上海交通大学医学院附属儿童医院)新生儿筛查中心];田亚平(解放军总医院医学创新部出生缺陷防控技术研究中心);王华(中国医科大学附属盛京医院小儿神经科);王秀霞(河北医科大学第二医院小儿内科);王艺(复旦大学附属儿科医院神经内科);文伟(深圳市妇幼保健院新生儿筛查中心);吴丽文(湖南省儿童医院神经内科);吴士文(解放军总医院第一医学中心神经内科);熊晖(北京大学第一医院儿科);薛敬洁(中国出生缺陷干预救助基金会);杨琳(西安交通大学第二附属医院儿科);杨茹莱(浙江大学医学院附属儿童医院遗传与代谢科);张淑(解放军总医院第一医学中心神经内科);邹卉(济南市妇幼保健院新生儿筛查中心)
中国研究型医院学会神经科学专业委员会 中国出生缺陷干预救助基金会神经与肌肉疾病防控专项基金组织专家组. 脊髓性肌萎缩症新生儿筛查专家共识(2023版)[J]. 中华医学杂志, 2023, 103(27): 2075-2081. DOI: 10.3760/cma.j.cn112137-20230310-00372.
所有作者声明不存在利益冲突































