
预防肾脏移植排斥反应离不开免疫抑制剂,但免疫抑制过度相关的感染也会影响移植肾和移植受者的存活。主动监测肾脏移植受者的免疫状态,有利于早期发现排斥反应风险或感染风险,有助于指导临床调整免疫抑制强度。本指南围绕我国目前可行的免疫监测指标进行推荐和说明,以期有利于提高移植肾和移植受者的长期存活。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾脏移植相比透析治疗可显著改善尿毒症患者的生活质量,但因为需要终身口服免疫抑制剂,肾脏移植受者有可能因为免疫抑制强度过高而引发感染和肿瘤,或因为免疫抑制不足而导致排斥反应。急性排斥反应(acute rejection, AR)和慢性排斥反应是肾脏移植后最常见的并发症,也是影响移植肾长期存活的重要危险因素。T细胞介导的排斥反应(T cell-mediated rejection, TCMR)的诊治相对容易,而抗体介导的排斥反应(antibody-mediated rejection, AMR)治疗起来则较为困难,花费高且效果欠佳,是导致移植肾失功的重要原因。
肾脏移植后免疫监测旨在通过一些检测指标,来侧面反映受者的免疫状态是否相对适度、有无免疫抑制过度或免疫抑制不足,以指导临床医师对免疫抑制方案进行合理调整,力求达到免疫状态的相对平衡。本指南根据国内外文献,结合国内现有可行的检测手段,对现有的免疫监测指标进行讨论,具体包括:针对人类白细胞抗原(human leukocyte antigen, HLA)的供者特异性抗体(donor specific antibody, DSA)、非HLA抗体、供者来源细胞游离脱氧核糖核酸(donor-derived cell-free deoxyribonucleic acid, dd-cf DNA)、淋巴细胞亚群及细环病毒(toque-teno virus, TTV)。其中HLA-DSA监测较为成熟且意义重大,一些非HLA抗体近年来备受关注,淋巴细胞亚群监测应用较多且具有一定的临床意义,dd-cf DNA和TTV属于新兴指标但可能具备较好的应用前景。
本指南由中华医学会器官移植学分会组织制订,并已在国际实践指南注册与透明化平台(http://www.guidelines-registry.cn)上以中英双语注册(注册号:PREPARE2023CN854)。指南的制订方法和流程主要基于2014年WHO发布的《世界卫生组织指南制订手册》[1]和2016年中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》[2]。首先通过指南专家会议对临床关注的问题进行讨论,选出本指南拟解决的12个临床问题,涉及HLA-DSA、非HLA抗体、dd-cf DNA、淋巴细胞亚群和TTV这5大指标的检测和临床应用。证据检索与筛选参考了国内外相关指南、共识、系统评价、Meta分析以及各类临床研究报道95篇。采用《牛津大学循证医学中心分级表2009版》对每个临床问题的证据质量和推荐强度进行分级(https://www.cebm.ox.ac.uk/resources/levels-of-evidence/oxford-centre-for-evidence-based-medicine-levels-of-evidence-march-2009,表1)。最终专家组基于证据评价提供的证据,综合考虑我国肾脏移植现状、检测成本和利弊等因素后,提出了符合我国肾脏移植免疫监测临床诊疗实践的推荐意见24条。
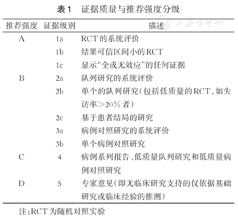
证据质量与推荐强度分级
证据质量与推荐强度分级
| 推荐强度 | 证据级别 | 描述 |
|---|---|---|
| A | 1a | RCT的系统评价 |
| 1b | 结果可信区间小的RCT | |
| 1c | 显示"全或无效应"的任何证据 | |
| B | 2a | 队列研究的系统评价 |
| 2b | 单个的队列研究(包括低质量的RCT,如失访率>20%者) | |
| 2c | 基于患者结局的研究 | |
| 3a | 病例对照研究的系统评价 | |
| 3b | 单个病例对照研究 | |
| C | 4 | 病例系列报告、低质量队列研究和低质量病例对照研究 |
| D | 5 | 专家意见(即无临床研究支持的仅依据基础研究或临床经验的推测) |
注:RCT为随机对照实验
临床问题1:肾脏移植后HLA-DSA监测的临床意义?
推荐意见1:HLA-DSA是同种异体B细胞免疫应答的结果,是导致AMR发生的主要原因。监测HLA-DSA是目前临床肾脏移植后重要和成熟的免疫监测手段(推荐强度B,证据等级2a)。
推荐意见2:肾脏移植术后早期(30 d内)对预致敏受者HLA-DSA的监测,有助于急性AMR的预警及诊疗。及时治疗以降低或清除DSA,能有效逆转急性AMR并显著改善移植肾的早期预后(推荐强度B,证据等级2a)。
推荐意见3:肾脏移植30 d后对新生DSA(dnDSA)的监测,有助于后期活动性或慢性活动性AMR的及时诊断。尽早采用针对dnDSA的干预治疗,可能可以延缓移植肾AMR病理损伤的进展,改善移植肾的长期预后(推荐强度B,证据等级2a)。
推荐意见说明:
移植肾的长期存活与多种因素相关,其中AMR是导致移植肾失功的主要危险因素之一。AMR的发生与HLA-DSA密切相关,DSA的检测是目前临床上最重要和最成熟的免疫学监测指标[3]。肾脏移植术后HLA-DSA包括预存DSA和新生DSA(de novo DSA,dnDSA)2大类,根据2019年国际移植学会专家共识[4]及2022年《肾移植后期抗体介导排斥反应防治专家共识》[5]:肾脏移植术后30 d内发生的AMR定义为早期AMR,30 d后发生的AMR称为后期AMR,尽管预存DSA也可能参与介导后期AMR,但多数后期AMR与dnDSA相关。
预致敏受者肾脏移植术后30 d内易出现由预存DSA或诱生DSA所导致的早期AMR,其中诱生DSA主要由特异性记忆性B细胞在移植后早期的再次免疫应答产生,表现为移植术前阴性,但在术后2周内快速、大量产生[6]。移植术后30 d内严密监测DSA的变化有助于判断预致敏受者发生AMR的免疫风险。如DSA显著升高,能提示临床医生及时进行移植肾穿刺活检,明确病理诊断和启动抗体针对性治疗(如血浆置换/静脉注射丙种球蛋白等),从而预防或逆转急性AMR,有效提高预致敏受者移植肾的早期存活率[7]。
文献报道肾脏移植术后dnDSA的发生率在4.6%~23.0%[8,9,10]。其中,DQ位点的发生比例最高且更易导致移植肾肾小球病,与移植肾长期预后不良显著相关[11,12,13]。因此,肾脏移植30 d后定期监测dnDSA能有效预警潜在的AMR,在亚临床阶段尽早干预治疗,能延缓甚至避免后期AMR的进展,改善移植肾的长期预后[14]。
临床问题2:目前HLA-DSA的监测有哪些常用检测方法及如何选择?
推荐意见4:因肾脏移植后采用供者细胞进行DSA检测的可行性较低,目前临床上主要采用固相检测法对HLA-DSA进行检测,包括酶联免疫吸附法、包被混合HLA抗原微珠的Luminex检测法(混合抗原微珠法)、包被HLA单抗原微珠的Luminex检测法(单抗原微珠法)以及包被群体反应性HLA抗原的流式检测法(流式PRA)(推荐强度D,证据等级5)。
推荐意见5:推荐使用混合抗原微珠法进行HLA抗体的初筛,使用单抗原微珠法进行DSA的确定(推荐强度D,证据等级5)。
推荐意见6:单抗原微珠法是目前判读DSA是否存在及水平高低公认的特异性方法。但需要注意的是,该方法可能因包被抗原的变异导致假阳性结果,也可能因抗原覆盖不足导致假阴性结果(推荐强度D,证据等级5)。
推荐意见说明:
采用供者细胞检测受者血清中的DSA,被称为"交叉反应",是最经典的AMR体外模拟检测法[15]。自1960年应用至今,一直是检测DSA并确认其补体依赖的细胞毒(complement-dependent cytotoxicity,CDC)作用等功能的首选方法。此法的优点是不仅可以检出HLA-DSA,还可以在绝大多数非HLA未知的情况下,检测非HLA-DSA,并对HLA或非HLA-DSA破坏供者靶细胞的CDC等损伤机理进行确认。对于绝大多数遗体捐献供者,移植后无法获取新鲜的供者淋巴细胞,因此通过供者活细胞进行的DSA检测难以实现。目前临床上主要采用包被HLA抗原的固相检测法进行DSA检测,包括酶联免疫吸附法、包被混合HLA抗原微珠的Luminex检测法(混合抗原微珠法)、包被HLA单抗原微珠的Luminex检测法(单抗原微珠法)及包被群体反应性HLA抗原的流式检测法(流式PRA)[16]。
酶联免疫吸附法在过去曾被广泛使用,但该法使用的血清量大,而敏感性相对偏低。目前临床上主要采用Luminex混合抗原微珠法对DSA进行初筛,通过包被多种不同HLA抗原的混合微珠与受者血清进行反应,判断有无抗HLA抗体。初筛阳性时,再通过包被单一抗原的微珠与受者血清反应,对照供者位点,进一步鉴别是否为DSA,为临床诊断AMR提供依据。此外,还可以对DSA水平进行半定量分层,在连续监测中辅助评估受者的免疫风险[17]。
微珠包被的抗原为纯化自人源细胞(混合抗原法、PRA抗原法)或重组表达的蛋白抗原(单抗原法),在制备过程中难免存在抗原结构变性,不同种属来源的抗原结构表现也有所差异,因此在抗体检测过程中可能存在少数假阳性情况。此外,由于荧光标记的微珠能够包被的抗原数量有限,一般不超过一百种,无法满足HLA抗原多态性的要求,故可能出现漏检的情况。也由于现有商业化的检测试剂主要针对国外人群的HLA多态性设计,导致中国人群在使用时可表现出假阴性[18]。
临床问题3:单抗原微珠法检测DSA的阳性阈值如何判定?
推荐意见7:通常以平均荧光强度(mean fluorescence intensity, MFI)来反映抗体水平。但必须强调的是,MFI值不能代表抗体的真实滴度,而是评价抗体水平的半定量指标。不同试剂盒、不同实验室对同一份血清检测的MFI值存在一定差异,各个实验室确定的阳性阈值也有所不同。一般以MFI值1 000作为DSA阳性阈值,也有实验室以MFI值500作为阳性阈值以避免漏检(推荐强度B,证据等级2a)。
推荐意见说明:
单抗原微珠法检测DSA的水平采用MFI值来表示,但不同移植中心判读DSA阳性的MFI阈值并不一致。目前国内、外大部分HLA实验室以MFI值等于1 000作为抗体阳性的判读阈值[19,20],也有一些实验室MFI值大于500即判为阳性[21,22,23]。鉴于目前还没有统一的MFI阈值标准,在有充分阴性对照结果支持的前提下,建议选用较低的阳性阈值,如MFI值大于等于500,以避免漏检早期出现的低水平DSA。MFI值越高可能提示DSA对移植物的损伤越重,但MFI值并不是可靠的独立预测因素,DSA损伤能力也与DSA的种类、亚型及补体结合能力等相关[24,25]。即使DSA的MFI值小于3 000,也可影响移植物存活[26]。建议移植受者在检测出DSA后,接受移植肾穿刺活检以明确病理改变程度,以帮助指导治疗及评估预后。
临床问题4:肾脏移植后不同免疫风险人群进行HLA-DSA监测的频率?
推荐意见8:对于免疫低风险人群,目前还没有统一确定的HLA-DSA监测频率,一般建议至少在移植后3~6个月及12个月各监测1次,之后每年监测1次(推荐强度B,证据等级3a)。
推荐意见9:对于免疫中风险人群,建议在移植后早期增加HLA-DSA监测频率,在移植后1个月内每1~2周监测1次;高风险人群在移植后1个月内每周监测1次,之后依据DSA的具体情况而定(推荐强度B,证据等级3a)。
推荐意见说明:
依据移植前不同的免疫风险分级,不同风险人群的DSA监测频率不尽相同。一般认为初次非致敏受者为低风险人群,多次移植或既往致敏但术前DSA阴性的受者为中风险人群,术前DSA阳性或经历脱敏治疗后DSA转阴的受者为高风险人群[27]。
针对免疫低风险人群,2023年欧洲器官移植协会(European Society for Organ Transplantation, ESOT)组织制定的《肾脏移植术后DSA监测临床应用指南》[17]指出,目前移植后DSA监测频率尚无统一标准,但基本要求在移植后3~6个月进行1次抗体监测,之后每年监测1次。Parajuli等[28]的研究表明,移植1年内无须进行过于密集的DSA筛查,92%的AMR和76%的亚临床AMR发生在移植1年后。但监测间隔超过1年可能是不可取的,因为未经治疗的亚临床AMR在诊断后1年内会向慢性病变进展[29]。2022年《中国肾移植后期抗体介导排斥反应防治专家共识》[5]提出,低风险人群建议在移植后1、3、6、12个月监测DSA,而后每半年或1年监测1次。需要强调的是,在随访期间,如果受者出现蛋白尿、输注红细胞、发生TCMR、BK病毒感染或其他原因导致的血肌酐升高,应立即检测抗体[3]。如果出现DSA阳性,建议立即予以移植肾穿刺活检。
针对免疫中风险和高风险人群,多项研究提出移植术后1个月内需严密监测DSA变化。一般要求每1~2周检测1次,移植后3~6个月和移植后12个月时各检测1次,之后每年监测1次[5,16,17,19,30]。如果受者在随访期间出现进行性加重的蛋白尿或血肌酐升高,应增加DSA检测,必要时予以移植肾穿刺活检。
临床问题5:检测HLA-DSA补体结合能力和抗体亚型的临床意义?
推荐意见10:采用固相法检测HLA-DSA的补体(C1q,C3d)结合能力,可能有助于进一步评判DSA的免疫危害性。DSA的补体结合能力越强,移植物的损伤越严重,但DSA的补体结合力为阴性并不代表其对移植物无损伤作用,仍然需要进行移植肾穿刺活检(推荐强度B,证据等级2c)。
推荐意见11:HLA-DSA的抗体亚型包括IgG1、IgG2、IgG3和IgG4。其中IgG3亚型的补体结合能力较强,与活动性AMR相关且与移植肾失功的相关性最大;IgG4亚型与亚临床AMR相关,且主要导致慢性移植肾肾小球病。检测和区分HLA-DSA的IgG亚型可能有助于识别DSA的免疫风险(推荐强度C,证据等级4)。
推荐意见说明:
研究表明,DSA阳性受者中,C1q结合阳性DSA的比例约为31%~42%,且C1q结合阳性受者的移植物存活率明显低于C1q结合阴性受者[31,32,33]。在进行AMR诊断时,检测DSA是否为C1q阳性是预测移植肾失功的一个强有力指标,且不受病理C4d沉积和DSA的MFI值的影响[34,35]。但也有研究表明,DSA的MFI值越高,C1q结合阳性的可能性越大[36]。
在高致敏受者中,移植前预存DSA的C3d结合试验可以较为准确地预测实际的CDC试验结果,C3d结合试验阴性有利于确定HLA抗体缺乏激活补体能力[37]。一项儿童肾脏移植研究将受者分为dnDSA阴性组、C1q阳性/C3d阴性组、C3d阳性组和dnDSA阳性但C1q阴性/C3d阴性组,4组儿童受者的10年移植物存活率分别为94%、100%、40%和100%,提示DSA的C3d结合能力与长期预后显著相关[38]。不过值得注意的是,2023年ESOT工作组制定的《肾脏移植术后DSA监测临床应用指南》[17]指出,即使DSA的补体结合能力为阴性,也不能排除DSA介导的免疫损伤,仍需通过移植肾穿刺活检来明确诊断。
移植后DSA对移植物的损伤作用与DSA的亚型有一定相关[39]。IgG亚型包括:IgG1、IgG2、IgG3和IgG4。其中,IgG1亚型占比最高,将近75%;IgG3的危害性最大,与移植肾长期存活最为相关[31];IgG4与亚临床AMR相关,且主要导致慢性移植肾肾小球病[32]。但目前相关证据主要来自国外研究,国内应用较少。对于有条件的中心,分析IgG亚型可能有助于识别DSA的免疫风险。
临床问题6:目前用于肾脏移植术后免疫监测的非HLA抗体主要有哪些?
推荐意见12:目前肾脏移植后需要监测的非HLA抗体种类尚未明确,已知与肾脏移植预后相关的非HLA抗体主要包括:主要组织相容性复合体-Ⅰ类相关链A(MICA)抗体、谷胱甘肽S-转移酶T1(GSTT1)抗体、血管紧张素Ⅱ-1型受体(AT1R)抗体、内皮素A受体(ETAR)抗体、波形蛋白(Vimentin)抗体等(推荐强度B,证据等级2a)。
推荐意见说明:
非HLA抗体是指导致移植物损伤或排斥反应的HLA抗体以外的抗体。目前已发现的非HLA抗体多数是针对次要组织相容性抗原、内皮细胞、上皮细胞、细胞骨架、胞外基质以及各种与移植肾不良预后相关的蛋白抗原[40,41,42]。非HLA抗体可分为同种异体多态性抗原抗体和自身抗原抗体两大类。文献报道同种异体非HLA抗体包括主要组织相容性复合体-Ⅰ类相关链A(major histocompatibility complex class I chain-related gene A,MICA)抗体、谷胱甘肽S-转移酶T1(glutathione-S-transferase T1, GSTT1)抗体、男性供肾移植给女性受者中的Y染色体编码蛋白(H-Y抗原)抗体等[43]。常见的自身抗体包括血管紧张素Ⅱ-1型受体(angiotensin II-type 1 receptor,AT1R)抗体、内皮素A受体(endothelin A receptor,ETAR)抗体、波形蛋白(Vimentin)抗体、基底膜蛋白多糖(Perlecan)的免疫原性片段(LG3)抗体等[44]。
临床问题7:肾脏移植术后非HLA抗体监测的临床意义?
推荐意见13:多种非HLA抗体与慢性活动性AMR有关,部分伴有特征性的病理表现,并对移植肾造成不同程度损伤。非HLA抗体单独或协同HLA-DSA影响移植肾功能,降低移植肾存活率(推荐强度B,证据等级2b)。
推荐意见14:临床或病理诊断为AMR或混合性排斥反应时,如果HLA-DSA为阴性,建议进行非HLA抗体检测(推荐强度B,证据等级2a)。
推荐意见说明:
非HLA抗体与肾脏移植AMR相关,可显著影响移植肾的长期预后[45,46,47]。MICA抗原是一种高度多态性的糖蛋白,由位于HLA复合体内的6号染色体上的主要组织相容性复合体(major histocompatibility complex, MHC)Ⅰ类相关链条编码,在46.4 kb处着丝粒于HLA-B位点。MICA抗原在内皮细胞、上皮细胞、单核细胞和树突状细胞上表达,但不在T或B淋巴细胞上表达[48,49]。MICA抗体可通过妊娠、输血、既往移植等经典致敏事件产生,也可在没有致敏的情况下出现[50]。移植前预存MICA抗体与移植后排斥反应相关,可显著降低移植肾1年存活率[51]。供受者MICA等位基因错配是新生抗MICA供者特异性抗体产生的主要原因[52]。在HLA匹配的受者中,MICA错配与移植肾失功独立相关[52]。移植前预存及移植后新生的供者特异性MICA抗体可独立于HLA-DSA,也可与之协同发挥作用,增加发生排斥反应和移植物失功的风险[52]。
GSTT1定位于细胞质,主要在肝脏和肾脏中表达。20%的白种人以及11%~58%其他种族个体存在GSTT1基因缺失[53]。GSTT1基因缺失受者在肾脏移植术后产生GSTT1抗体的概率较GSTT1基因表达受者高,移植肾存活率下降[54]。GSTT1抗体也可在GSTT1基因表达者中检出,类似于自身抗体。高水平(MFI>8 031)GSTT1抗体为AMR和移植肾丢失的独立预测因子[54]。此外,GSTT1基因缺失受者在循环和移植物内HLA抗体均为阴性的情况下,随着同种异体GSTT1抗体的产生和在移植物内的沉积,AMR可进展为移植物失功[54]。研究显示,发生AR受者的GSTT1抗体阳性率(8/19,42.1%)高于移植物功能稳定受者(4/27,14.8%)[55]。
AT1R抗体可能与C4d阴性的难治性AMR有关,病理检查通常有动脉内膜炎、纤维素样坏死以及肾小管炎和间质炎症细胞浸润等特征性表现,其导致移植肾损伤的机制可能是AT1R抗体与AT1受体结合后激活下游信号而模拟血管紧张素Ⅱ的作用[56]。一项纳入1 845例肾脏移植受者的多中心回顾性研究显示,77例受者(4.2%)在移植肾活检中表现为早期AMR,但未检测到HLA-DSA;而这些AMR病例中,大多数(66.2%)可检测到AT1R抗体,且移植物损伤的严重程度与AT1R抗体水平相关[57]。另一项研究指出,移植前预存的AT1R抗体是远期移植物失功的独立危险因素,且与早期较高的AR发生率相关[58]。AT1R抗体和HLA-DSA双阳性常见于高致敏肾脏移植受者,抗体间有协同作用[59];二者均为阳性的移植肾存活率显著低于仅DSA阳性者的移植肾存活率[60]。
ETAR抗体和AT1R抗体之间存在高度相关性。一项儿童肾脏移植队列研究也发现,ETAR抗体和AT1R抗体常伴随出现,2种抗体同时阳性与动脉内膜炎、IL-8水平升高和移植后2年肾小球滤过率下降>30%显著相关[61]。此外,预存的ETAR抗体也可独立影响移植肾早期功能。一项研究发现,有47.4%的受者存在预存的ETAR抗体,其在术后1个月和1年时的移植肾功能都明显较ETAR抗体阴性受者差;虽然经病理活检证实的AR在预存ETAR抗体和ETAR抗体阴性受者中的发生率相近,但轻至重度动脉内膜炎在预存ETAR抗体受者中更为常见[62]。关于ETAR抗体导致移植肾损伤的机制目前尚不清楚,推测分为补体依赖性途径和非补体依赖性途径2种[63]。
波形蛋白是一种细胞骨架蛋白,通常不在细胞表面表达。在移植或排斥反应过程中的内皮损伤可导致波形蛋白暴露,成为具有免疫原性的自身抗原。研究发现,44%活检证实的慢性排斥反应受者在移植肾失功后可检测到波形蛋白抗体,协同HLA-DSA在间质纤维化和肾小管萎缩中发挥作用[64]。移植前波形蛋白抗体阳性也可能是移植后间质纤维化和肾小管萎缩的危险因素[65]。
基底膜蛋白多糖是一种细胞外基质蛋白多糖,由许多单独的结构域组成,在蛋白水解过程中可释放具有免疫原性的片段(LG3)[66]。研究表明,移植前预存LG3抗体和HLA-DSA都是移植后AMR的独立危险因素;移植后,LG3抗体会加速同种异体免疫应答导致的移植物血管损伤[67]。在HLA预致敏肾脏移植中,排除新生HLA-DSA的影响,预存和新生LG3抗体也可诱发早期AMR[68]。
非HLA抗体产生的具体机制及其与HLA-DSA之间的相互关系尚未完全明确。由于临床中已观察到多种非HLA抗体也可独立导致移植肾损伤,影响移植肾预后。因此,对于肾脏移植术后临床或病理诊断为AMR或混合性排斥反应的受者,如无明确的HLA-DSA依据,应检测非HLA抗体[69]。
临床问题8:dd-cf DNA监测的临床意义?
推荐意见15:dd-cf DNA水平升高提示存在移植肾损伤,持续低水平的dd-cf DNA则高度提示移植肾无损伤,从而可能避免不必要的穿刺活检和抗排斥治疗(推荐强度B,证据等级2b)。
推荐意见16:血浆dd-cf DNA升高对AMR的诊断价值较高,对TCMR的诊断价值有限。当临床高度怀疑TCMR时,即使血浆dd-cf DNA为较低水平也不能排除TCMR,必要时还是应行移植肾穿刺活检以确诊(推荐强度B,证据等级2b)。
推荐意见17:抗排斥治疗期间动态监测dd-cf DNA可能有助于评估移植肾的恢复情况和预后(推荐强度B,证据等级2b)。
推荐意见说明:
dd-cf DNA是指器官移植术后受者循环体液中来源于凋亡或坏死供者细胞的游离DNA,其水平升高往往提示细胞更新和死亡增加[70]。
尿液和血浆dd-cf DNA水平升高提示移植肾出现损伤[71,72]。国外最新ADMIRAL研究对1 092例肾脏移植受者进行了为期3年的dd-cf DNA监测,发现血浆dd-cf DNA水平升高与亚临床和临床排斥反应显著相关,且在新生DSA检出前3个月即可监测到dd-cf DNA水平升高[73]。反之,持续低水平的dd-cf DNA可在很大程度上提示移植肾无损伤,从而可能减少不必要的穿刺活检和避免盲目的抗排斥治疗[72,73]。
虽然有研究指出,发生亚临床AMR及TCMR时,受者的血浆dd-cf DNA水平可以出现升高[73];但也有单中心队列研究指出血浆dd-cf DNA仅对AMR的诊断价值较高(曲线下面积为0.82),难以区分TCMR和无排斥反应的情况(AMR、TCMR和无排斥反应受者的血浆dd-cf DNA百分比(dd-cf DNA%)中位数分别为1.35%、0.27%和0.38%)[74]。因此,在临床高度怀疑TCMR时,dd-cf DNA检测为阴性并不能排除TCMR的诊断,必要时仍需进行移植肾穿刺活检予以明确。
国内小样本前瞻性队列研究显示,受者的血浆dd-cf DNA%在抗AR(5例AMR和13例IA级以上TCMR)治疗前后的下降幅度与受者治疗后1、3、6个月时估算的肾小球滤过率(estimate glomerular filtration rate,eGFR)显著相关[75]。提示抗排斥治疗期间dd-cf DNA的动态监测可能有助于反映移植肾的恢复和预后。
临床问题9:肾脏移植后dd-cf DNA监测在鉴别诊断中的临床意义?
推荐意见18:dd-cf DNA的阳性检测结果虽能提示移植肾损伤,但对损伤原因的鉴别能力有限(推荐强度B,证据等级2b)。
推荐意见19:联合血浆和尿液的dd-cf DNA检测对于鉴别AMR和TCMR,以及鉴别BK病毒感染和BK病毒相关肾病,具有一定参考价值(推荐强度B,证据等级2b)。
推荐意见说明:
多项研究显示,尿液或血浆dd-cf DNA虽在诊断移植肾损伤方面有较好价值,但对鉴别损伤原因,比如移植肾功能延迟恢复、AR、急性肾小管坏死、BK病毒肾病(BK virus-associated nephropathy, BKVN)等,缺乏特异性[71,72]。
但在鉴别AMR和TCMR方面,受者的血浆dd-cf DNA改变有一定辅助诊断价值。一项包含102例肾脏移植受者的队列研究显示,发生AMR受者(包括混合性AR)与未发生AMR受者(包括单纯TCMR)相比,血浆dd-cf DNA%的差异有统计学意义,且排斥反应越重,血浆dd-cf DNA水平越高[76]。前文提过的小样本队列研究也显示,出现AMR受者的血浆dd-cf DNA%(中位数为1.35%)高于出现TCMR的受者(中位数为0.27%),差异有统计学意义(P=0.01)[74]。
此外,2020年国内一项纳入40例确诊BKVN、7例疑似BKVN、23例可能BKVN和23例自愈BKVN受者的研究显示,确诊和疑似BKVN受者尿液的dd-cf DNA水平[(22.09±21.27)ng/ml和(15.64±6.73)ng/ml]高于可能和自愈BKVN受者的尿dd-cf DNA水平[(5.60±3.53)ng/ml和(5.30 ± 3.34) ng/ml],检测尿dd-cf DNA水平可能有助于鉴别BKVN和BK病毒感染[77]。
临床问题10:dd-cf DNA的检测结果如何判定?
推荐意见20:血浆dd-cf DNA%大于0.5%是目前较合适的阳性判断阈值(推荐强度B,证据等级2b)。
推荐意见21:结合运用血浆和尿液dd-cf DNA的百分比和绝对值,有助于提供更全面的诊断信息(推荐强度B,证据等级2b)。
推荐意见说明:
dd-cf DNA检测方法目前主要是基于二代测序(next-generation sequencing,NGS)或微滴式数字PCR(droplet digital PCR,ddPCR)的"供者基因分型非依赖"检测,通过直接在受者的总细胞游离DNA检测数据中鉴别dd-cf DNA的信号大小,计算后者所占绝对值和百分比[78,79]。百分比相对更加常用,但阳性判断阈值尚无定论,目前最新的研究认为,血浆dd-cf DNA%大于0.5%较合适[73]。虽然早年一项纳入102例肾脏移植受者的前瞻性队列研究结果显示,未发生排斥反应受者的血浆dd-cf DNA%中位数为0.3%,而发生排斥反应受者的中位数为1.6%,故提出1%为诊断活动性排斥反应的阈值[76]。国内一项纳入37例肾脏移植受者的单中心前瞻性研究也显示,血浆dd-cf DNA%阈值定为1%时,诊断AMR的敏感性为88.9%、特异性为73.7%、阳性预测值为76.2%、阴性预测值为87.5%[80]。另一项纳入63例肾脏移植受者的回顾性队列研究提出dd-cf DNA%大于0.74%为诊断AR的最佳阈值[74]。但2022年最新的ADMIRAL研究(多中心1 092例)显示,血浆dd-cf DNA%大于0.5%为诊断移植肾损伤的可靠阳性阈值,dd-cf DNA%持续<0.5%提示移植肾无损伤[73]。
由于dd-cf DNA%同时受到供者细胞和受者细胞释放细胞游离DNA的影响,故只以dd-cf DNA%作为估计指标可能并不全面。一项对189例肾移植受者进行了1年术后随访的前瞻性队列研究显示,以dd-cf DNA的绝对值诊断活检证实的AR的准确率明显优于dd-cf DNA%(曲线下面积分别为0.83和0.73,P<0.01)[72]。dd-cf DNA绝对值可消除由于受者个体差异导致总体细胞游离DNA增加而引起的dd-cf DNA%下降,可以作为对dd-cf DNA%的补充[70,81]。不同方法检测dd-cf DNA绝对值时的单位可分为拷贝/ml和ng/ml,推荐统一使用拷贝/ml。
临床问题11:淋巴细胞亚群能否作为肾脏移植后免疫状态监测的有效指标?
推荐意见22:T淋巴细胞亚群中CD4+T细胞和CD8+T细胞的数量、百分比及CD4+/CD8+比值变化,可能反映免疫抑制不足或者过度,对AR或某些感染有一定辅助诊断价值,与预后也有一定相关性(推荐强度D,证据等级4)。
推荐意见23:通过细分CD4+T细胞和CD8+T细胞的不同亚群或动态监测,可能有助于预测移植后感染和AR的潜在风险(推荐强度D,证据等级4)。
推荐意见说明:
国内有几项早年的单中心小样本观察显示,肾脏移植后AR发生时,CD4+T细胞的百分比升高、CD8+T细胞百分下降、CD4+/CD8+比值升高;反之在感染发生时,CD4+T细胞的百分比下降、CD8+T细胞的百分比上升、CD4+/CD8+比值降低[82,83,84]。比如一项纳入79例接受兔抗人胸腺细胞免疫球蛋白(rabbit anti-human thymocyte globulin,rATG)诱导的肾脏移植受者研究显示,CD4+T细胞的百分比在AR组高于肾功能稳定组(48.8%±8.8%比39.7%±8.6%),而CD8+T细胞百分比在巨细胞病毒(cytomegalovirus,CMV)感染组高于肾功能稳定组(42.5%±13.8%比29.0%±9.1%);AR组CD4+/CD8+比值较CMV组高(2.9±0.7比0.6±0.3),并在AR缓解后降低(1.8±0.5),提示CD4+/CD8+比值对AR及CMV感染的诊断具有一定临床价值[82]。对于近年更为常见的BK病毒感染,国内报道显示,T细胞相关亚群在BK病毒肾病组和AR组间差异没有统计学意义,CD4+/CD8+比值在AR组(68例)、BK病毒肾病组(73例)和肾功能稳定组(31例)分别为1.4±0.8、1.2±0.6和1.2±0.7;然而CD19+B细胞比例和绝对数在BK病毒肾病组低于AR组(8.5%比13.2%,94/mm3比202/mm3)[83]。此外,国内有研究观察了移植肾功能稳定状态下的CD4+/CD8+比值,45例无感染或出现AR受者在术后1、3、6个月的CD4+/CD8+比值分别为1.6±1.0、1.5±0.8和1.4±0.7[84]。淋巴细胞亚群的动态监测对预测肾脏移植受者的感染和排斥反应发生具有一定意义,CD4+T细胞和CD4+/CD8+比值为独立危险因素[85]。
国外有研究表明,CD4+T细胞数量的长期减少(<300个/mm3)与移植后肿瘤、移植物功能加速下降和受者死亡显著相关[86]。另一项对38例HIV阳性肾脏移植受者的研究显示,移植后4周时CD4+T细胞数量的严重减少(<200个/mm3)与移植后6个月内的严重感染事件显著相关[87]。此外一项对49例肾脏移植后罹患耶氏肺孢子菌肺炎的研究也显示,CD4+T细胞计数<200个/mm3与住院期间死亡显著相关[88]。
Crepin等[89]研究对62例接受rATG诱导的肾脏移植受者后发现,若移植时终末分化的CD8+T细胞在总CD8+T细胞中的占比(CD28-CD57+CD8+/CD8+)>34%,则移植后受者感染CMV的风险增加3倍;而移植时终末分化的CD4+T细胞在总CD4+T细胞中的占比(CD28+CD57+CD4+/CD4+)每增加1%,移植后患机会性感染的风险可下降80%。此外,移植时终末分化的CD28-CD57+CD4+在总CD4+T细胞的占比可帮助预测移植后AR(每增加1%,AR风险增加12%);而CD4+/CD8+比值下降可能提示移植后AR风险下降[89]。但对于接受巴利昔单抗诱导的35例受者,作者未发现这些亚群变化对移植后感染或AR的统计学预测力[89]。
临床问题12:细环病毒载量能否作为肾脏移植术后免疫状态的监测指标?
推荐意见24:肾脏移植受者的细环病毒阳性率高,其拷贝数变化可能可以作为肾脏移植受者免疫状态监测的辅助指标(推荐强度B,证据等级2b)。
推荐意见说明:
细环病毒(TTV)因具有以下特点而可能成为评估移植受者免疫力的辅助指标:①高携带率:TTV可在高达90%的健康个体中检测到,移植受者中TTV的检出率接近100%;②高安全性:尚未发现TTV与任何人类疾病相关;③复制和清除活跃:据估计每天有约3.8×1010的TTV病毒在健康人体中产生,其中超过90%会被免疫系统清除,因此病毒载量会随免疫功能变化而实时改变;④相对稳态:在免疫功能正常的个体中,血浆TTV水平受宿主免疫能力的调节而维持稳定状态,且该病毒不受常规抗病毒药物治疗影响;⑤检测方法可及:尽管不同种类TTV间的序列多样性很丰富,但在TTV基因组的5'非翻译区存在一个保守的碱基序列,检测方法主要包括:使用Spezia等[90]开发的PCR方法,或者商业标准化的PCR试剂盒(Real-time detection and quantification kit, TTV R-GENE; bioMérieux SA, France) [91];⑥能反映免疫抑制强度的变化:一项纳入了76例肾脏移植受者的队列研究表明,TTV载量能反映肾脏移植后霉酚酸类药物的短期服用剂量的变化,因此可能用于监测肾脏移植受者的免疫能力[92]。
一项纳入了386例肾脏移植受者的队列研究同时对TTV载量和肾脏移植术后感染进行了风险分层,发现TTV载量每增加1个log,感染风险增加11%(P<0.001)。TTV载量在1×106~1×108拷贝/ml之间,是平衡肾脏移植受者AR和感染风险的最佳范围[93]。一项系统综述和Meta分析表明,TTV载量与器官移植术后2年内的感染都和AR具有相关性,TTV载量每增加1个log,感染风险增加16%,AR风险下降10%[94]。但另一项聚焦肾脏移植的Meta分析表明,TTV仅可作为预测AR的风险分层指标,敏感性、特异性和ROC曲线下面积分别为0.61、0.81和0.79,但TTV对感染的预测效果不佳[95]。国内关于肾脏移植受者TTV的多中心队列研究正在进行中(临床研究注册号:NCT05727709)。
排斥反应和感染是影响移植肾和移植受者存活的重要并发症。本指南基于我国肾脏移植高质量发展的主要目标,针对肾脏移植术后临床免疫监测的常见问题进行推荐和说明,主要内容为抗体相关的检测,如HLA-DSA及非HLA抗体的监测。指南同时对近年来备受关注的dd-cf DNA、淋巴细胞亚群及TTV等相关免疫指标进行了阐述。但本指南的部分临床问题目前尚缺乏有力的循证医学证据,同时在临床实践中也有待验证,如:非HLA抗体在肾脏移植后定期监测的必要性、血浆dd-cf DNA监测的适应证和监测频率以及如何通过淋巴细胞亚群变化指导调整免疫抑制剂的使用等。尽管如此,本指南建议各移植中心重视移植术后免疫监测,尽可能配备齐全的实验设备,联合多个监测指标,包括定期进行移植肾穿刺活检,来综合判定受者的免疫状态。这将有助于更加精准地、个体化地调整免疫抑制方案。
主审专家:
薛武军 西安交通大学第一附属医院
朱同玉 复旦大学附属中山医院
审稿专家(按照姓氏拼音排序):
蔡俊超 苏州才博医学研究所
崔 瑜 浙江大学医学院附属第一医院
董 震 青岛大学附属医院
付迎新 深圳市第三人民医院
何 军 苏州大学附属第一医院
胡小鹏 首都医科大学附属北京朝阳医院
林 涛 四川大学华西医院
刘龙山 中山大学附属第一医院
戎瑞明 复旦大学附属中山医院
尚文俊 郑州大学第一附属医院
寿张飞 杭州(树兰)医院
孙启全 广东省人民医院
田普训 西安交通大学第一附属医院
王树森 天津市第一中心医院
王彦峰 武汉大学中南医院
王长希 中山大学附属第一医院
王振兴 山西白求恩医院
吴建永 浙江大学医学院附属第一医院
张 明 上海交通大学医学院附属仁济医院
郑 瑾 西安交通大学第一附属医院
周洪澜 吉林大学白求恩第一医院
执笔作者:
朱 兰 华中科技大学同济医学院附属同济医院
陈 刚 华中科技大学同济医学院附属同济医院
郭志良 华中科技大学同济医学院附属同济医院
张 雷 海军军医大学第一附属医院
蔡俊超为苏州才博医学首席科学家,苏州才博医学致力于开发符合中国人群特点的移植免疫相关抗体和组织损伤标志物的检测试剂,并为临床提供系列性的检测服务;其他作者均声明不存在利益冲突



























